原子量は化学を学ぶ上で欠かせない重要な概念ですが、一見すると複雑で分かりにくいと感じる人も多いかもしれません。しかし、原子量は炭素を基準に他の原子の重さを相対的に表したもので、具体的にはとてもシンプルな仕組みです。この授業では、原子量がどのように定義され、計算されるのかを丁寧に解説します。
原子量ってなに?
今日は「原子量」について勉強しよう。「原子量」って聞いたことあるかな?
化学の教科書に出てきた気がするけど、詳しくは覚えていないです……。
そうだよね。じゃあ、まず簡単に説明するね。
「原子量」というのは、原子1個の質量を表した値のことだ。ただし、実際には原子1個の重さをそのまま表しているわけではなく、ある基準をもとにした相対的な値なんだよ。
「相対的な値」ってどういうことですか?
たとえば、500円玉の重さが7g、5円玉の重さが3.5gだとする。このようなグラムなどの単位を用いて表した質量は「絶対質量」と呼ばれている。
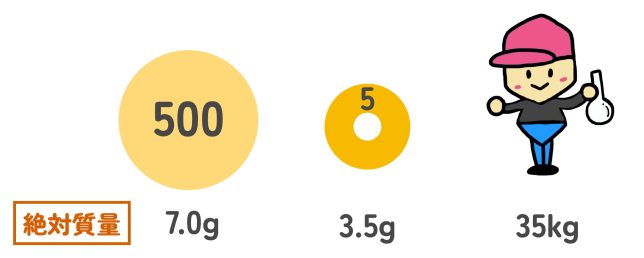
それに対して、500円玉の重さを表すとき、「500円玉は5円玉の2枚分の重さ」って表現することもできるよね?
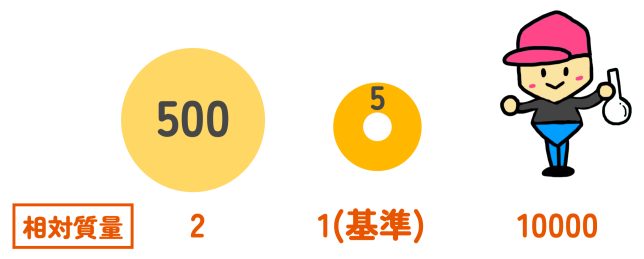
はい、それならわかります!(僕は5円玉1万枚分の重さなのか…)
500円玉の重さを、5円玉を基準にして表したわけだ。このような質量の表し方を、「相対質量」という。あるものを基準として、他のものがどのくらいか、というように、相対的な値で表しているんだね。
さて、あらためて、原子の質量を考えるときは、絶対質量と相対質量、どちらが良いだろうか。ちなみに、絶対質量だとこんな風になるね。

0.0000000……167gって、小さすぎてよくわかりませんね。
そうだろう。だから、原子は相対的な値(相対質量)を使って表すほうがわかりやすくなる。これが「原子量」だ。
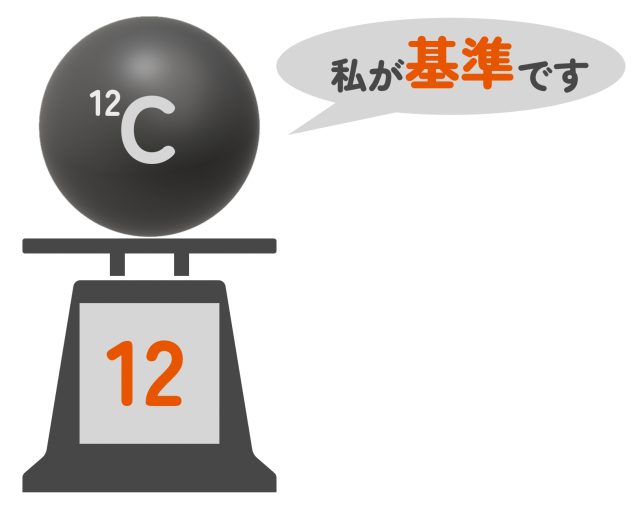
ただし、基準となるのは12Cという炭素原子だ。この炭素の質量をちょうど12(端数なし、単位なし)と決めて、他の原子の重さを比べているんだよ。12Cとは簡単にいうと、この世界で一番ありふれている炭素原子のことだ。
原子量の計算方法
じゃあ、12Cを基準にして、他の原子の原子量を見てみよう。たとえば、水素(H)は炭素の約1/12の質量だから、原子量はおよそ「1」になる。酸素(O)は炭素の約4/3の質量だから、原子量はおよそ「16」だよ。

だいぶ、スッキリしましたね。
でも、同じ種類の原子でも重さが少し違うものがありましたよね?
その通り!同じ元素でも、中性子の数が違う「同位体」っていうものがあるんだ。たとえば、炭素には基準にもなっていた「12C」のほかに、「13C」や「14C」なんていうもある。増えた中性子のぶん、少しだけ重いレアな炭素だね。
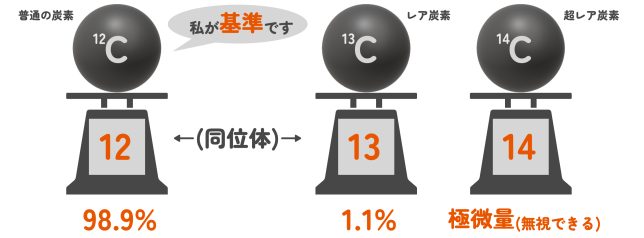
このことから、自然界に存在する割合を考慮して、「平均的な質量」を計算するんだよ。そしてその値が元素の「原子量」として計算に使われるんだ。ためしに炭素の原子量を計算してみるよ。14Cはほとんど存在しないから無視するね。
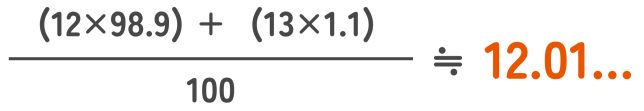
計算したら、炭素原子の原子量は12.01ですか。
ほとんどの周期表には、それぞれの元素の原子量の値が記載されているはずだよ。この数字は、同位体の存在比率まで考慮した値なんだよ。
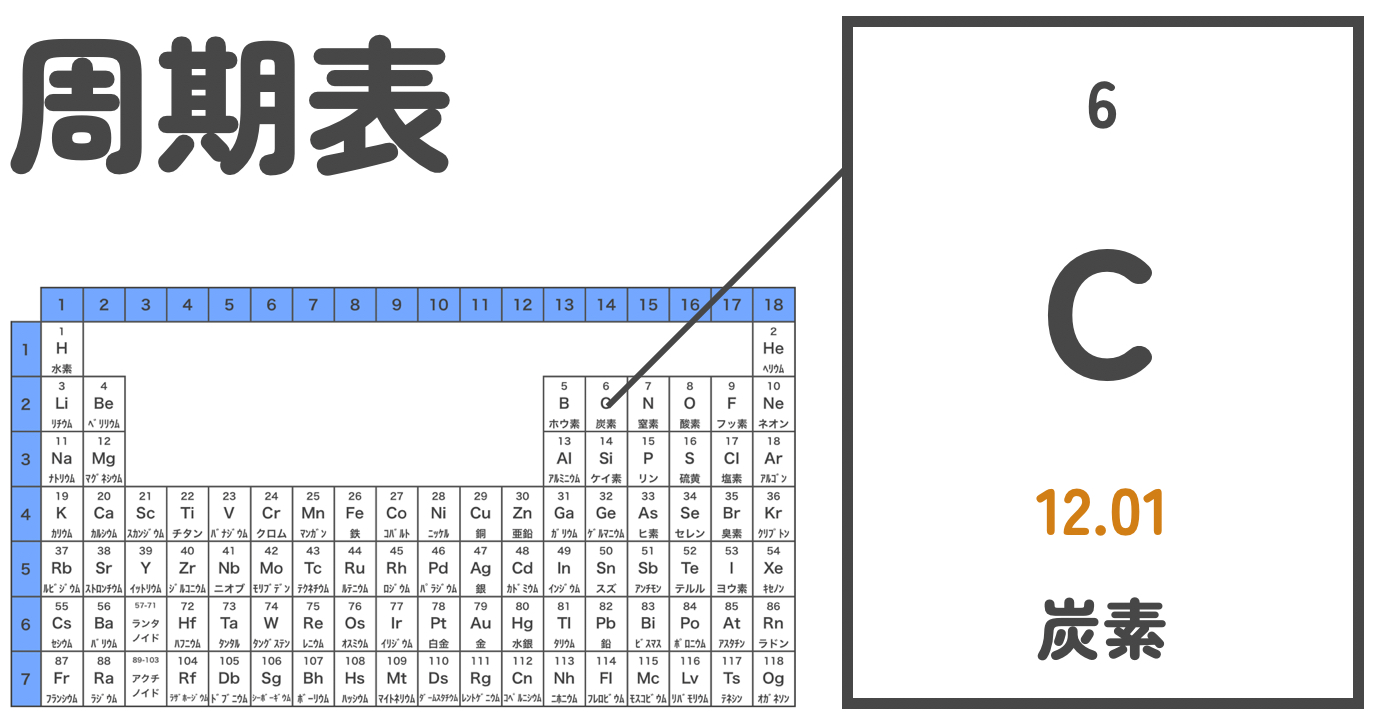
あ!確かに炭素は12ではなく、12.01になってますね!
同じように、水素(H)の原子量は1.0じゃなくて、正確には「1.008」くらいなんだ。これも、自然界に存在する水素の同位体である1H、2H、3Hの割合を考慮して計算されているからだよ。
じゃあ、学校の問題でよく見る「炭素の原子量は12とする」というのは、少し省略してるってことなんですね。
その通り!実際の値は小数点以下も含めるともっと細かいけれど、計算を簡単にするために四捨五入しているんだね。

え!?覚えるんですか?
心配いらない。覚えなくても問題文に書いてあるよ。もっとも、よく使うから、多分勉強しているうちに覚えてしまうだろうけどね。
原子量の使い方
ところで、原子量って具体的に何に使われるんですか?
① 分子量を計算できる
H2やCO2のような分子の「分子量」が計算できるよ。
分子量は、分子式中の元素の原子量の総和のことだよ。例えば、水素分子H2と二酸化炭素CO2の分子量はわかるかな?先ほどのコレを使ってね。

ええと、水素(分子)は1.0× 2 = 2.0
二酸化炭素は12 + 16×2 = 44
になります。
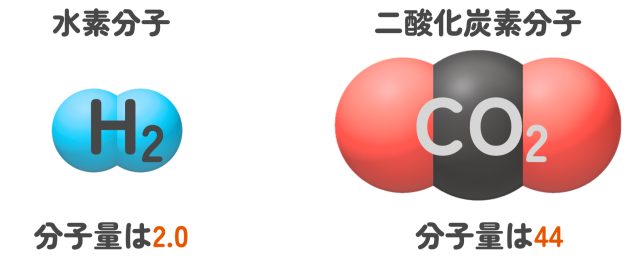
OK。つまり、二酸化炭素1分子の重さは、水素1分子の22倍の重さになるということがわかるね。
空気は、だいたい酸素(分子量32)と窒素(28)からなりますので、水素(2.0)は空気より軽い気体、二酸化炭素(44)は重い気体ということがわかりますね。
おお!いきなり理解が早いね!
② 式量を計算できる
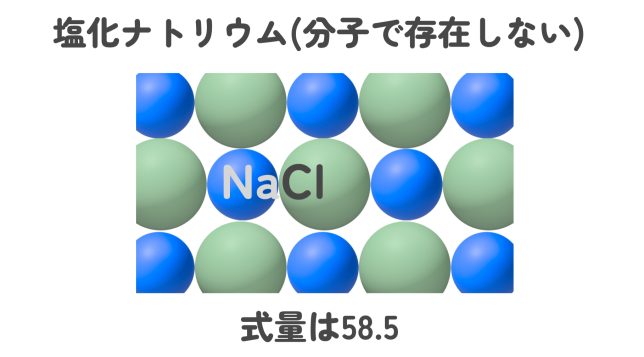
イオンからできている物質のように、分子で存在しないで組成式で表す物質の場合は、組成式中の元素の原子量の総和を「式量」というよ。まぁ、分子量と同じことだね。例えば、塩化ナトリウムNaClの式量は?
塩化ナトリウムの組成式はNaClですから、23 + 35.5 = 58.5 ですね!
バッチリだね。
③ 物質量(次回学習)と合わせて様々な化学計算ができる
化学では今後「モル」という単位を使って「物質量」を考えるけれど、原子量はその基本となるんだよ。例えば、1モルの炭素の(絶対)質量は、
12(原子量) × 1(モル) = 12(グラム)
と計算され、12グラムとわかる。
なるほど!今後の化学の計算に必要なんですね。
そうだね。モルの計算については、長くなるからまた次回詳しく学ぼう。
まとめ
今日学んだことを整理してみよう!
1. 原子量は、原子の質量を炭素12を基準にして表した相対的な値。
2. 同位体がある場合は、自然界での存在比を考慮した「平均の値」を使う。
3. 原子量は、分子量や物質のモル計算に役立つ。
これからも化学の勉強で何度も使うから、しっかり覚えておこうね!
はい、ありがとうございました!
問題 地球上には35Clが75%、37Clが25%存在している。塩素の原子量を計算せよ。
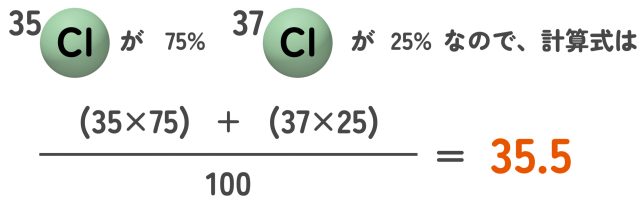
答え 35.5










