化学反応では、物質が決まった比率で反応し、生成物ができるという「量的な関係」が成り立っています。この量的関係を理解することは、化学を学ぶうえでとても重要です。例えば、「水を作るには水素と酸素がどれくらい必要なの?」という疑問も、このルールを使えば解けます!ここでは、化学反応式を使った量的な関係の基本を見ていきましょう。
化学反応の量的関係とは?
化学反応式はだいぶ書けるようになりましたが、『化学反応の量的関係』って、なんですか?
化学反応における『反応物と生成物の量』についての関係だよ。
H₂(水素)とO₂(酸素)からH₂O(水)ができる反応は書けるかな?

こうですね。H₂(水素)とO₂(酸素)が反応物、H₂O(水)が生成物となります。
バッチリだね。これは
「水素分子2つと酸素分子1つが反応して、水分子2つができる」
ということを意味しているよね。このように、化学反応における分子の割合は、化学反応式に基づいて決まっている。
一般に『化学反応式の係数の比は,各物質の物質量〔mol〕の比と等しい』んだよ。
先ほどの反応式の係数の比は、H₂ : O₂ : H₂O = 2 : 1 : 2 であるので、反応する物質量〔mol〕の比もH₂ : O₂ : H₂O = 2 : 1 : 2 であるということですね。
そういうこと。物質量〔mol〕がわかれば、そこから質量〔g〕や粒子数、気体の場合は体積〔L〕を計算することもできる。こうして、化学反応に関係している物質どうしの関係を知ることができるんだ。以下に簡単に計算できる円を乗せておくよ。
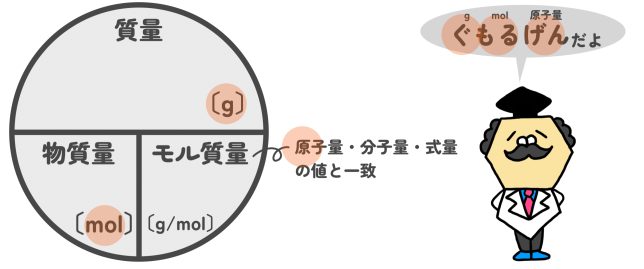
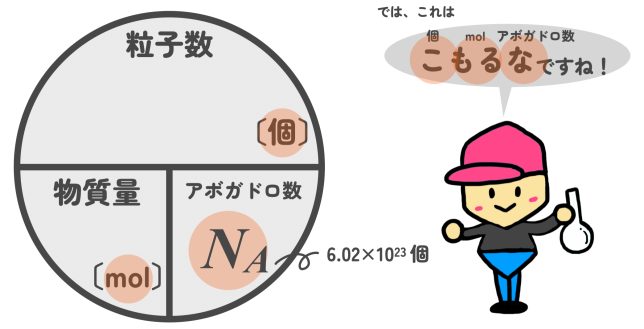
なお、気体の体積は標準状態(0℃、大気圧)で1molあたり22.4Lとなります(後述)。

よって、物質量(mol)がわかれば、そこから『質量』『粒子数』『(気体の)体積』が計算できます。

1. モルを使った量の計算
では、実際に計算してみよう。
問題 水素H₂6.0gに酸素O₂32gを反応させると、水H₂Oは何gできるか計算せよ。ただし、原子量はH=1.0, C=12, O=16とする。
え?!『質量保存の法則』により、6.0+32=38gじゃないんですか?
お、その法則をよく知っていたね。でも、本当にそうかな?次のステップで計算してみよう。
ステップ① 化学反応式を書く

まずは、化学反応式を正確に書きましょう。
ステップ② モルに換算する
• 水素H₂の分子量は(2.0)なので、6.0gの水素の物質量は
6.0g ÷ 2.0 = 3.0mol
• 酸素O₂の分子量は(32)なので、32gの酸素の物質量は
32g ÷ 32 = 1.0mol
これが、化学反応前に存在する各物質の物質量(mol)となります。

ステップ③ 化学反応式の係数比から反応量を求める
反応式の係数の比は、H₂ : O₂ : H₂O = 2 : 1 : 2 であるので、反応する物質量〔mol〕の比もH₂ : O₂ : H₂O = 2 : 1 : 2 です。いま、酸素が1.0molなので、反応する水素は2.0molとなります。しかし、3.0mol(6.0g)の水素があるので、1.0mol(2.0g)が反応できずに余ることがわかります。変化量は、水素が−2.0mol、酸素が−1.0molですね。

水素と酸素は反応によって減りますので、変化量にマイナスをつけるんですね!
そうだね。足りない酸素は、その結果全て消費される。
反応できる量は、少ない(足りない)方に合わせるのがポイントだ。
ステップ④ 生成する水の量を計算
2.0molの水素と1.0molの酸素が反応すると、生成する水H₂Oの量は、化学反応式の係数の比がH₂ : O₂ : H₂O = 2 : 1 : 2 であるので、2.0molであることがわかる。

水H₂Oの分子量は(18)であるので、生成する水の質量は
2.0mol × 18 = 36g …(答)
今回の結果をまとめると、2.0molの水素H₂(=4.0g)と1.0molの酸素O₂(=32g)が反応すると、2.0molの水H₂Oが36gできるということだね。
反応した物質だけで計算すると、4.0 + 32 = 36 が成り立っていることがわかる。これが、有名な『質量保存の法則』だよ。化学反応の前後で、質量が変わらないという法則だね。
なるほど!単純に足せばいいわけではなく、過不足がある場合もあるから、きちんと化学反応式と物質量の考え方を使って計算する必要があるんですね。
毎回、ピッタリ用意されているとは限らないからね。今回のように過不足がある場合は、何が足りなくなるかをしっかり見極めることが大事だよ。
2. 気体反応における体積について
気体の反応の場合「気体の体積」を答えさせる問題もあるよ。
ステップは先ほどとほとんど同じだ。
問題 窒素N₂5.6gに水素H₂を過不足なく反応させてアンモニアNH3とするために必要な水素は標準状態で何Lか。ただし、原子量はH=1.0, N=14とする。
今回は「過不足なく反応」ですね。
ステップ① 化学反応式を書く
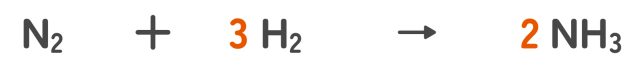
ステップ② モルに換算する
• 窒素N₂の分子量は(28)なので、5.6gの水素の物質量は
5.6g ÷ 28 = 0.20mol
ステップ③ 化学反応式の係数比から反応量を求める
反応式の係数の比は、N₂ : H₂ = 1 : 3 であるので、反応の際の物質量〔mol〕の比もN₂ : H₂ = 1 : 3 です。いま、窒素が0.20molなので、過不足なく反応する水素は0.60molとなりますね。答えは、0.60mol…(答)と書きたいところですが、今回は体積〔L〕で聞かれています。0.60molの水素の体積は、何Lになるのでしょうか。
さて、ここで気体の体積について確認だよ。
標準状態(0℃、1気圧)では、1molの気体は22.4Lの体積をもつんだ。これは、『気体の状態方程式』というもので計算できるんだけど、今は「そういうものだ」と暗記しておけばいいよ。

0.60molの水素の体積は、0.60 × 22.4 = 13.44〔L〕…(答)となりますね。
気体の体積って、こんなに簡単に計算できるんですね!
本日のまとめ
化学反応の計算をマスターすると、何がどれだけ反応して、どのくらいの物質ができるのかが計算できるってわけだ。これは、いうまでもなく実験をする際に必須の知識だよね。繰り返して慣れていこう。
わかりました!引き続き、頑張ります!
✔︎ 化学反応の量的関係は、反応式の係数比を使う。
✔︎ molの計算は、質量→mol→体積の順に換算すると便利。
✔︎ 標準状態では、1モルの気体は22.4Lの体積をもつ。











