化学では,ある物質が水にどれだけ溶けているかを表すために「濃度」という指標を使います。
濃度の表し方にはいくつか種類があり,それぞれで意味が少しずつ異なっています。ここでは,高校化学で必ず使う『質量パーセント濃度』と『モル濃度』を中心に,応用として『質量モル濃度』も紹介します。計算が苦手な人も,仕組みから理解すれば必ずできるようになるはずです。
溶液の濃度とは?
博士!「濃度」って,いったい何を表しているんですか?単位も〔%〕とか〔mol/L〕とか、いくつか濃度の単位が出てきて、訳がわからないんです!
ふむ。化学においてとても重要なことを学んでいるようだね。
濃度というものが表れるのは、溶液についての話なんだ。だから、まず溶液がどういうものかを理解しておかなければならない。
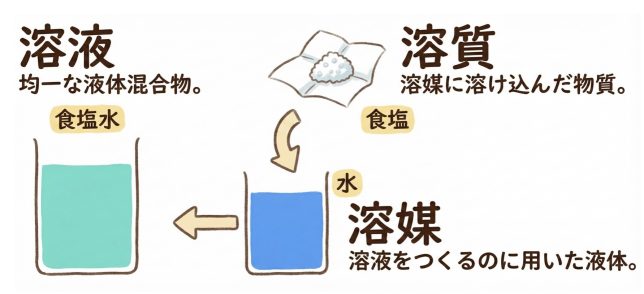
「溶液」は、「溶質」(溶ける物質)と「溶媒」(溶かす物質)からできている。例えば、食塩水という溶液は、食塩(溶質)が水(溶媒)に溶けたもののことを指す。溶媒が水の場合は、特に「水溶液」という。
ふむふむ、”溶質”が”溶媒”に溶けて”溶液”となるんですね。
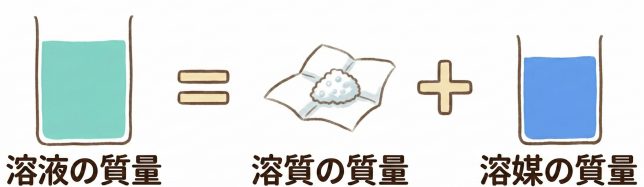
そういうこと。だから、溶液の質量は溶質と溶媒を足したものになっているよ。
さて、ではいよいよ濃度についてだ。
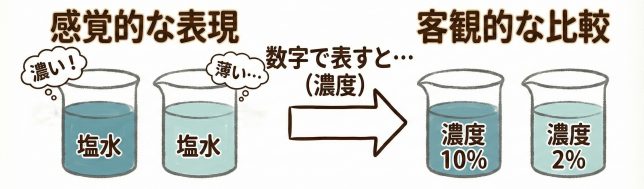
濃度とは「溶質がどれだけ入っているか」を表す量のことだよ。濃さを数字で表して,共通の尺度で比べられるようにするためだね。
「食塩水は”濃い”とか”薄い”」という表現だと、どうしても感覚的なものになってしまうだろう?
た、確かに。きのう食べたラーメン、友達は「味が薄い」と言っていましが、僕は「濃い」と感じました。人にもよりますね。
そう。だから「濃度」として「数値化」することで客観的に比較できるようにするんだ。
このとき、数値化の仕方にいくつか種類があるため、濃度の表し方がいくつか存在することになるんだ。
濃度の表し方は実はたくさんあるんだけど、絶対に覚えておきたいのは2つだ。順番に紹介していくよ。
質量パーセント濃度〔%〕
では、まずは一番有名な「質量パーセント濃度」という濃度の表し方から見ていこう。
単位が〔%〕ですね。パーセントってことは,割合で表すんですか?
その通りだよ。質量パーセント濃度は「溶液全体の質量に対して,溶質が何%含まれているか」を示す濃度なんだ。式で書くとこうだよ。
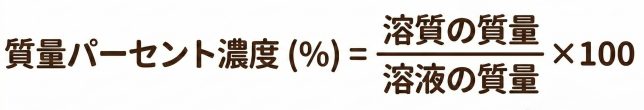
一問例題を解いてごらん。
問題
食塩 5 g を水 95 g に溶かした溶液の質量%濃度は?
簡単ですよ。
まず、水(溶媒)95g と食塩5g(溶質)を足して100g が食塩水(溶液)となりますね。
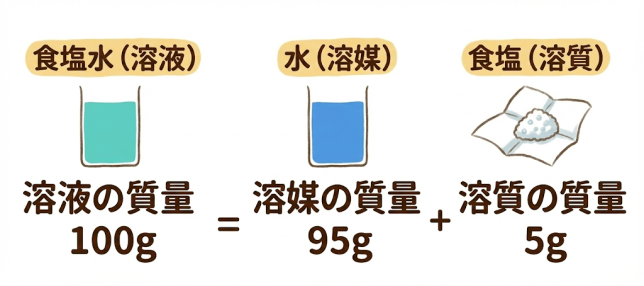
そのうち食塩(溶質)が5gだから、計算式に入れると…

5%ですね!
うむ。正解だ。
この〔%〕(パーセント)という単位で表すのは、確かによく見ますね。
あぁそうだね。日常的に濃度を表現するには一番わかりやすいだろう。

確かに。お酢やお酒など、スーパーに売っているものは%の単位で書いてあるものが多いですね。これが質量パーセント濃度という表し方なんですね。
そういうこと。では次に進もう。
モル濃度〔mol/L〕
次は「モル濃度」だ。
※モル濃度の理解には「物質量」の知識が必要です。

以前学習した「モル」を使う濃度ということですか?日常で聞いたことはない濃度の単位ですよね。
うん。化学では反応式をモル〔mol〕すなわち物質量で扱うから,モル濃度は化学を勉強する際の計算で特に便利なんだ。確かに日常では使わないね。
計算式は、こうだよ。

一問例題を解いてみよう。
問題
NaCl 5.85 g を水に溶かして 1.0 L の溶液を作った。モル濃度はいくつ?なお、原子量はNa=23、 Cl=35.5とする。
まず、NaCl の式量(式を構成する原子量の和)は 58.5 となりますね。NaCl 58.5g をまずはモル〔mol〕に変換したいから、ええと
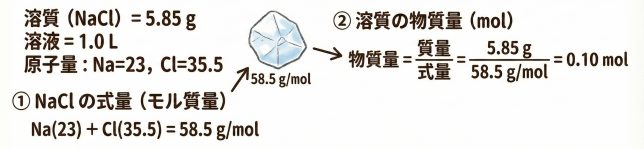
NaCl 5.85 g は、物質量で表すと 0.10mol のことです。
これを「溶液の体積」で割ればいいですね。「1.0Lの溶液」とあるので、そのまま1.0Lで割ればいいですよね。
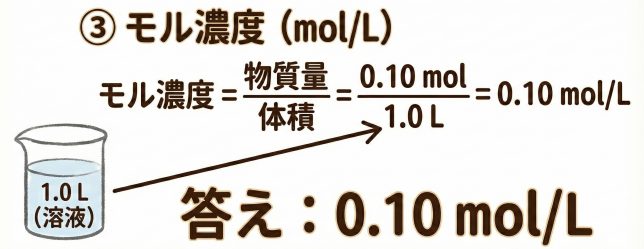
大正解!わかってきたみたいだね。
計算式は違いますが、どちらも本質的には「溶質がどれくらい入っているか」を数値化したものなんですね。
うむ。化学反応の実験は、溶液の中で行うことが多いからね。濃度の考え方はとても重要なんだ。特に、この「モル濃度」は化学ではメインとなる濃度の表し方になるよ。
実験をするにしても、まずは濃度調整から始まることも多い。素早く、正確に計算できるようにね!何回も繰り返し計算しているときっとすぐできるよ。
よーし!頑張るぞ!
【番外編】質量モル濃度〔mol/L〕
ところで博士、「質量パーセント濃度」と「モル濃度」以外で有名なものはありますか?
あるよ。
と言っても、一般的には使用頻度はグッと落ちてしまうけどね。次に有名なのは「質量モル濃度」かな。
なんだか「質量パーセント濃度」と「モル濃度」が合体したような濃度ですね…
溶媒 1 kg あたりに溶質が何 mol 含まれるかを表す濃度なんだ。式はこうなるよ。
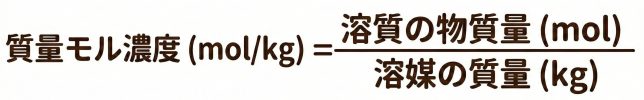
右側の分母には「溶液」ではなく「溶媒」の質量(kg)を使うことに注意!
覚えてしまえば、計算自体はなんてことないですね。
モル濃度と違って「溶媒の質量」を使うので,温度による体積変化の影響を受けにくい。「沸点上昇」や「凝固点降下」などの「希薄溶液の性質」に関する計算で使われるよ。まぁ、必要な人以外は今は知らなくてOKだ。
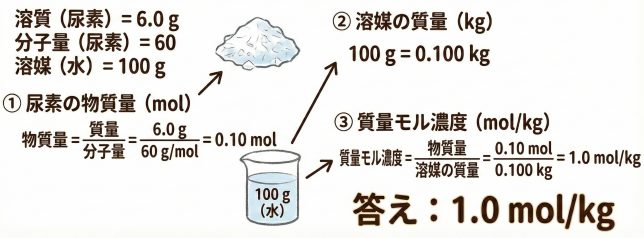
問題
尿素 6.0 g(分子量 60)を水 100 g に溶かしたときの質量モル濃度は?
ここまで知っていれば、困ることはまずないだろう。
✔ 溶液=溶質+溶媒
✔ 質量% = 溶質の質量 ÷ 溶液の質量 × 100
✔ モル濃度 = 溶質の mol ÷ 溶液の体積(L)
✔ 質量%濃度は日常用途、モル濃度は反応計算、質量モル濃度は応用計算に使う








