水に砂糖を入れると溶けますが、入れすぎると底に残ってしまいます。この「もうこれ以上溶けない」という状態には、実ははっきりした基準があります。それを数値で表したものが「溶解度」です。溶解度は、用語として覚えるだけでなく、温度との関係やグラフの読み取り、簡単な計算問題へとつながる重要な考え方となります。今回は、溶解度と溶解度曲線を整理していきましょう。
溶解度とは何か
博士、「溶解度」って、毎回説明を読むと分かった気になるんですけど、問題になると混乱します…。「濃度」との関係もイマイチピンとこないです。
なるほど。
ケミ太は甘いコーヒーが好きだったね。このブラックコーヒー(砂糖の入っていないコーヒー)に砂糖を入れていくと、砂糖の濃度はどうなる?
砂糖の濃度がどんどん上がっていきます。どんどん甘くなっていって…
あれ?最終的にはどうなるんでしょうか。
やってみようか。

コーヒーの底に、砂糖が沈澱していますね。これ以上溶けきれなくなった砂糖が、底に溶け残っているということですか?
そういうことだ。砂糖みたいに水に溶けやすい物質も、溶ける量には限界がある。これがまさに「溶解度」なんだ。
でも待ってください博士。コーヒー(溶媒)の量を増やしたら、まだ溶けますよね?
もちろんそうだ。だから、「基準」を設ける。
溶解度の基準は、考えやすくするために、溶媒(水)の量は「100g」とすることが多い。例えば、100gの水に最大で30g溶ける物質があったら、その物質の溶解度は30gと言えば良い。
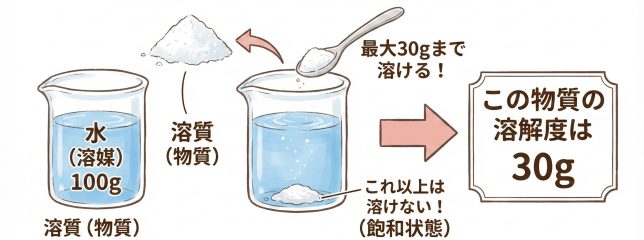
そして、溶解度の値に達している溶液は「飽和」状態というよ。飽和状態の溶液が、いわゆる飽和溶液だ。
この最高に甘そうなコーヒーは砂糖が飽和状態なんですね。

そうだね。沈澱が生じているということは、これ以上溶けない飽和状態だ。
一定量(ふつうは100g)の溶媒に溶質を加えていくと、ある量以上は溶けずに残るようになる。このときの溶液を「飽和溶液」という。この飽和溶液中に溶けている溶質の量を表したものが溶解度である。
溶媒が100gではないときはどうすればいいんですか?
簡単だよ。基準(100g)と比較して、比例で考えるんだ。
例えば、溶媒が50gなら溶ける量は半分ということだし、溶媒が200gあるなら2倍溶けるということだ。
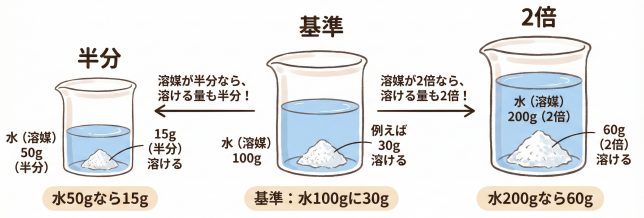
「水100gに30g溶ける(溶解度)」を基準とし、水が半分の50gなら溶ける量も半分の15g、水が2倍の200gあれば、溶ける量も2倍の60gとわかる。
温度と溶解度の関係
ということは、このコーヒーはこれ以上は甘くできないのか…
いや、できるよ。
実は、溶解度は、温度によって変化する値なんだ。このグラフを見てごらん。
これはなんですか?
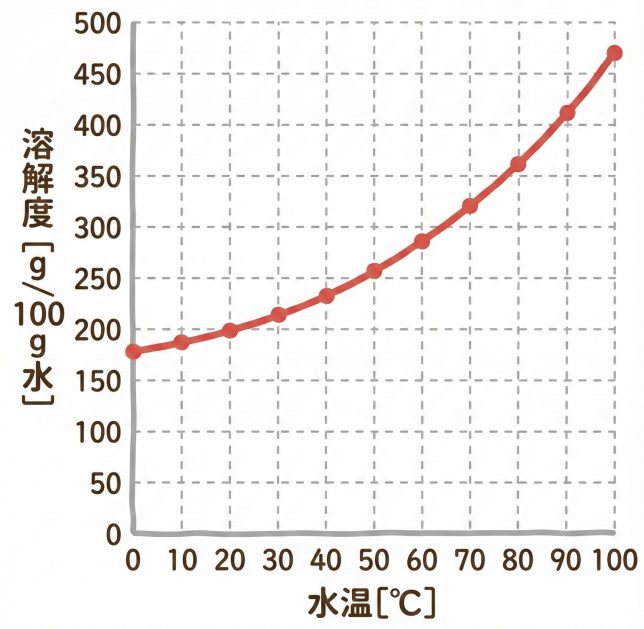
これはスクロースの「溶解度曲線」というグラフだ。横軸が温度、縦軸が溶解度となっている。「スクロース」というのは、お砂糖のことだと思ってくれればいい。
水温が高いほど、溶解度が大きくなっていますね。
スクロースのような固体の溶解度は基本的には右上がり、すなわち、温度が高いほど溶解度も高くなる。他の物質の例も見てみよう。
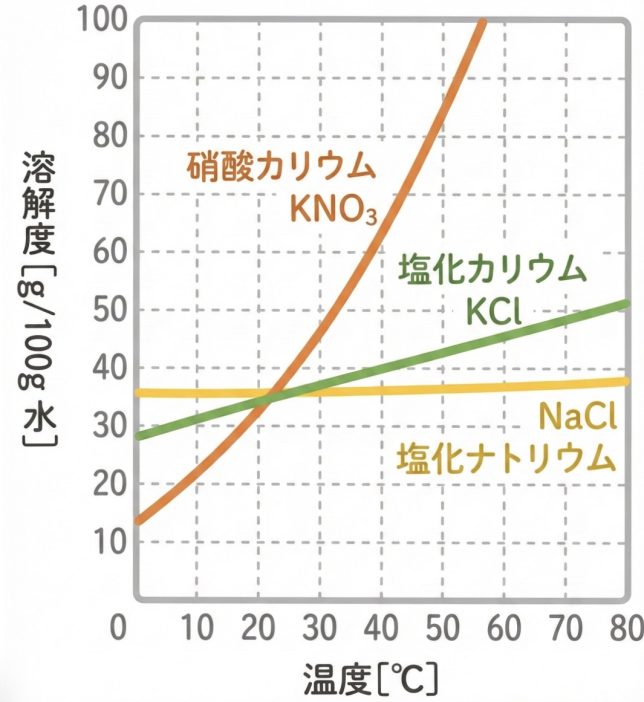
硝酸カリウムKNO₃は、温度が上がるにつれて溶解度が急激に大きくなることがわかる。一方、塩化カリウムKClは温度とともに溶解度は増加するが、その変化は比較的ゆるやかである。さらに、塩化ナトリウムNaClは温度が変わっても溶解度がほとんど変化しない。このように、溶解度の温度変化の大きさは物質によって異なる。溶解度曲線を用いることで、ある温度で溶質が最大何g溶けるかを読み取ることができる。
なるほど、温度が上げればもっと溶かせるんですね!
え!?まだ砂糖を入れたいのかい?
こんなの、甘ければ甘いほどいいですからね!
まあいいや。一問問題を解いてみよう。
問題
40°Cの水50gに塩化カリウムKClは何gまで溶けるか。下の図を参照して答えよ。

図から、40°Cの水に溶ける塩化カリウムKClの溶解度を読み取ると、だいたい40gですね。
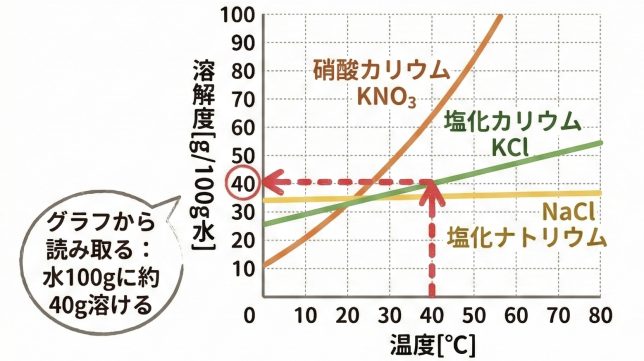
今回は水が50gだから、グラフの基準(100g)の半分です。だから、溶解度も半分の20gになるはずです!
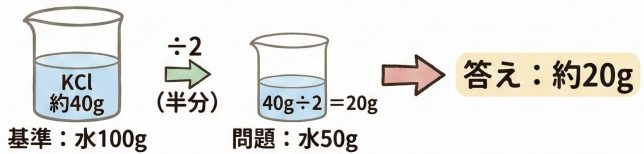
おっ。ひっかからなかったね!グラフはあくまでも100gの水に対してのグラフだから、きちんと今の水の量に換算しないといけないね。
大正解だ。好きなだけ砂糖を持っていきなさい。
やったー!
再結晶
あれ?浮かない顔だね。流石に砂糖入れすぎだったかい?
いえ、温度を50℃くらいまで上げたら、さらに砂糖をいっぱい溶かせたんですが、熱くて飲めなかったんです。
なるほど。
で、飲めるまで冷やしていたんです。すると今度は、コーヒーの底に、溶けていたはずの砂糖が出てきたんです。せっかく頑張って溶かしたのに!
それは「再結晶」だね!
さいけっしょう?
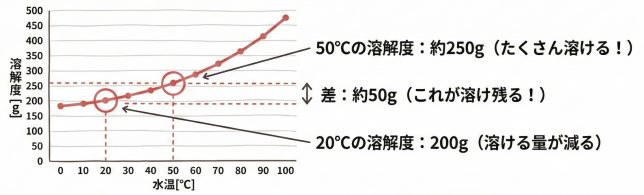
そう。先ほどの溶解度曲線をもう一度見てごらん。
ケミ太が50℃にしたときは、スクロースの溶解度は約250g、それに対して、今の温度は20℃くらいだから、溶解度は200gだね。
50℃のときに200gを超えて砂糖を溶かすと、冷やしたときに、溶け切れなくなって、再び溶け残りが結晶として出現するんだ。
確かに結晶っぽくなっています。再び結晶となって表れるから「再結晶」なんですね。
この「再結晶」は、実は化学における物質の精製操作として、とても重要な操作でもあるんだ。ゆっくりと冷やしてできた「結晶」は、純度が高いからね。無意識のうちにやってしまうとは、さすがだね。
なんか複雑な気持ちです…
まぁまぁ、気を取り直して一問問題を解いてみよう。
問題
硝酸カリウムKNO3の飽和溶液100gを60°Cで調製し、これを10°Cに冷やすと、何gの結晶が析出するか。数値で答えよ。ただし、硝酸カリウムは水100gに、10°Cで22g、60°Cで110g溶けるとする。
溶解度の値が、グラフではなくて文章で書いてありますね。
わかりにくかったら、図でまとめてみようか。硝酸カリウムは水100gに、10°Cで22g、60°Cで110g溶けるとする。のところを図にするとこんな感じかな。
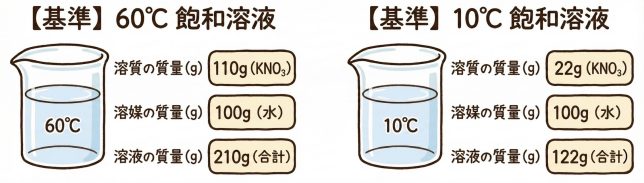
これは溶解度の【基準】であり、溶媒(水)が100gでの値ですね。
今回の問題では、「溶媒」ではなく「溶液」の質量が100gなので、比を使った換算が必要ですね。
60℃の時の飽和溶液は
溶質:溶媒:溶液=110:100: 210
【実際】には溶液が100gだから比を使って…
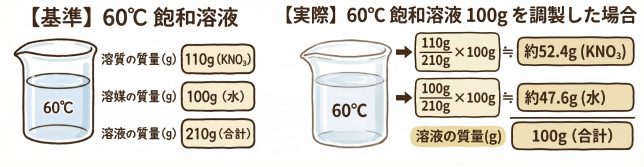
【実際】の溶液中には、【溶質(KNO3)】が52.4g、【溶媒(水)】が47.6gとなりますね。…ふぅ。この後どうすればいいんでしょう。
ここまであってるよ、どうしても計算が面倒くさくなりがちだけど、頑張って続けよう。
溶質であるKNO3が52.4g、溶媒である水は、47.6gあることがわかったね。この溶液を、いよいよ10℃に冷却するよ。
さて、このとき、溶質は一部が結晶となって析出しちゃうけれど、溶媒の水の量は10℃まで冷やしても47.6gのまま変わらないはずだ。
10℃の時の飽和溶液の【基準】は、水100gで最大量22g溶ける、でしたね。つまり溶媒:溶質=100:22ということですよね。
10℃の水47.6gに溶ける溶質の最大量をXとして、これも比を使って
100:22=47.6:X となりますから…
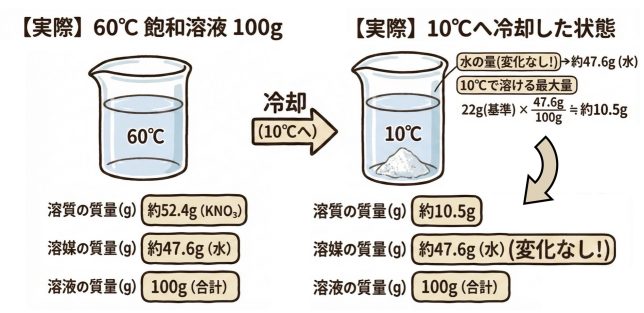
10℃の水47.6gに溶ける溶質の量は、約10.5gですね。
60℃の時の【実際】の溶質が52.4gでしたから、差の41.9gが析出ですね!
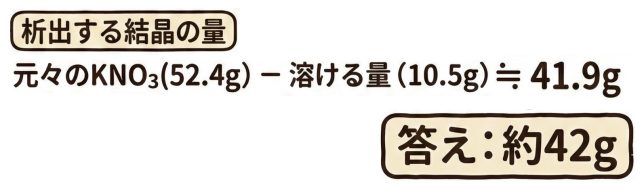
ちょっと難しかったけど、よくできたね。
まぁ、「慣れ」もあるから、めげずに計算してみてね!
✔︎ 溶解度は「それ以上溶けない最大量」を表す
✔︎ 溶解度は水100gを基準に決められている
✔︎ 温度が高いほど溶解度が大きくなる物質が多い
✔︎ 溶解度曲線で溶液の状態を判断できる
✔︎ 冷却すると再結晶が起こることがある







