化学反応では、物質のエネルギーが変化し、それが熱や光、電気として外に現れることがあります。例えば、カイロが温かくなるのも冷却剤が冷たくなるのも、化学反応の結果です。今回は、こうした化学反応のエネルギーの出入りや、その仕組みについて学びましょう!
1. 化学反応とエネルギー
化学反応が起きると、エネルギーが変化して、身近な現象に影響を与えることがあるよ。たとえば、どんなものを思い浮かべるかな?
うーん…カイロとかですか?触るとすごく温かくなるので、エネルギーが関係している気がします。
いいね。カイロでは、鉄粉が空気中の酸素と反応して熱を出しているんだ。この熱は『化学反応によってエネルギーが外へ放出されたもの』と見ることができる。そう考えると、冷却剤が冷たくなるのはどうしてだと思う?
えっと…逆にエネルギーを外から吸い取っているとか?
その通り。冷却剤の中では、物質が反応して周囲から熱を吸収しているんだ。『化学反応によってエネルギーが外から吸収された』ということだね。化学反応では、このように物質のエネルギーが変化するんだよ。この物質が持つエネルギーは、化学エネルギーと呼ばれているよ。
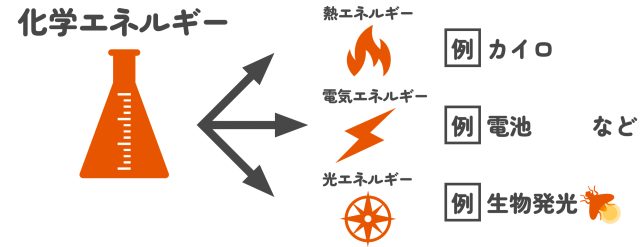
化学反応では、物質が持つエネルギーが変化します。このエネルギーは「化学エネルギー」と呼ばれ、物質ごとに異なります。反応によって原子間の結合が変化すると、エネルギーの大小が変わり、その差が熱や電気、光として現れるのです。
2. 系と外界の関係
次に、化学反応がどのようにエネルギーをやり取りしているのかを考えてみよう。化学反応が起きる部分を『系』、それ以外の周りの部分を『外界』と呼ぶんだ。
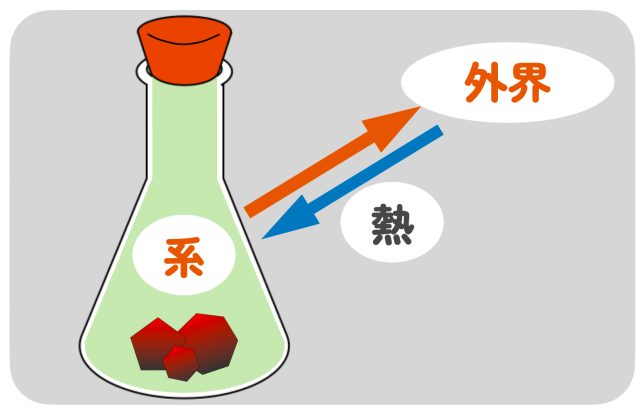
カイロの場合だと、鉄粉が酸素と反応している部分が“系”で、私たちの手や周りの空気が“外界”になるんですね。
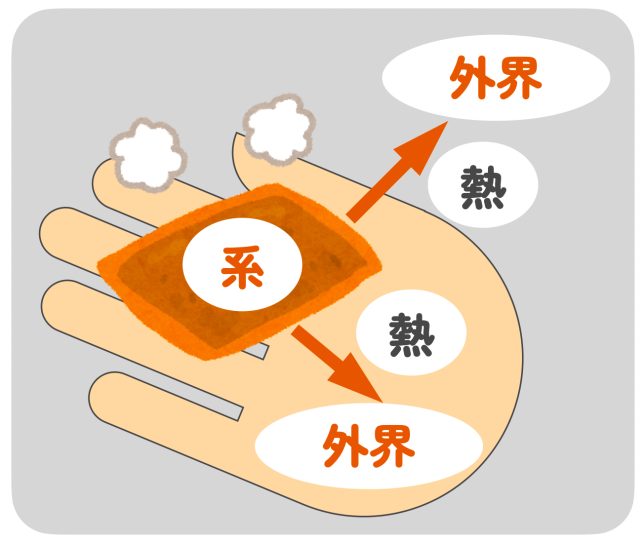
そういうことだね。化学反応では、系と外界の間でエネルギーのやり取りがあるんだ。
熱が系から外界に放出される場合は発熱反応、外界から系に吸収される場合は吸熱反応というよ。
カイロは発熱反応ですね!まぁ温かいですし、異論はないです。
カイロでは、鉄粉(Fe)が空気中の酸素(O₂)と反応して酸化鉄(Fe₂O₃)ができます。このとき、鉄1molあたり824kJの熱が放出されます。身近な発熱反応の代表例と言えるでしょう。なお、カイロの袋の中で起きている化学反応は、主に次の化学反応式となります。

一方、冷却剤の中では硝酸カリウム(KNO₃)が水に溶ける際に、周囲から熱を吸収します。こちらは、吸熱反応ですね。
3. エンタルピーとは?
次に、『エンタルピー』という言葉を覚えよう。これは化学反応で使われるエネルギーの量を表す言葉だよ。
なんだか難しそうですね…。
大丈夫だよ。エンタルピーは、物質が持つ化学エネルギーを表すものだと思えばいい。化学反応のとき、このエンタルピーが変化して熱が出たり吸われたりするんだ。
じゃあ先ほどのカイロのときにもエンタルピーが関係していたんですね?
そうだね。カイロでは、反応物(鉄粉と酸素)のエンタルピーが生成物(酸化鉄lll)のエンタルピーより大きいから、余ったエネルギーが熱として外界に放出されるんだ。図にするとこんな感じかな。
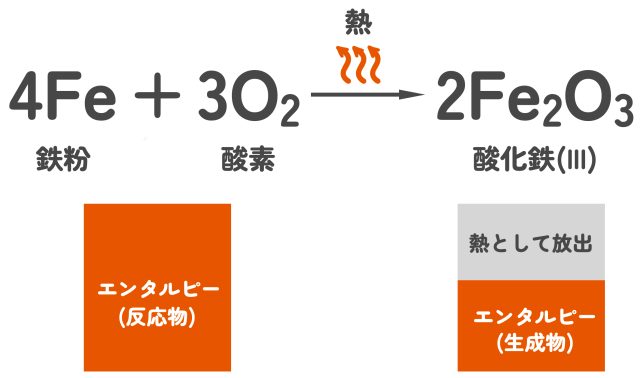
なるほど。カイロは発熱反応ですから、この関係が逆になると吸熱反応となるわけですね!

うむ。
反応の前後でのエンタルピー変化をΔHとすると、発熱反応では反応前後でエンタルピーが減少するからΔH<0となり、吸熱反応ではエンタルピーが増加するからΔH>0となるよ。
まわりくどい書き方だと思いましたが、減る場合は変化量はマイナス、増える場合は変化量はプラス、っていうだけのことですね。
ちなみに、エンタルピーは小さい方が安定だから、発熱反応の方が自然に起きやすいと言える。カイロは封を開ければ自然に温かくなるよね。
確かに、発熱反応の方が身近に多い気もしますね。
発熱反応の方が自然界や日常的な反応で頻繁に見られるため、種類も多い傾向にあります。ただし、吸熱反応も工業的なプロセスや生体内で重要な役割を果たします。
4. 化学反応が自発的(自然)に進む要因
ところで、化学反応が自然に進むかどうかは、エンタルピーだけで決まると思う?
エンタルピーが小さい方が安定だから、それだけで決まるんじゃないですか?
実はそれだけじゃないんだ。もう一つ重要な要素がある。それは『乱雑さ』だよ。
ランザツさ??ですか?
そう。乱雑さ。エントロピーとも言うよ。
エンタルピーの次はエントロピーですか。いよいよこんがらがってきました。
大丈夫!水を例に考えてみよう。氷と液体の水、どちらの水分子が乱雑(散らばっている)と思うかい?
水の方が自由に動き回れるので、乱雑になりそうです。
正解。これをエントロピーという言葉を使って表すと、
「固体(氷)よりも液体(水)の方がエントロピーが大きい」
と表現できるわけだ。エントロピーはSの文字で表すよ。
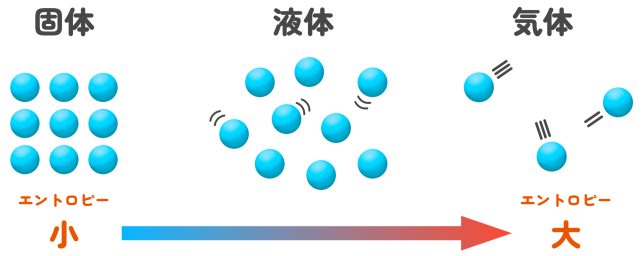
化学反応が自発的に進むかどうかは、エンタルピー変化と「エントロピー」の2つで決まります。エントロピーは物質の「乱雑さ」を表す量で、固体より液体、液体より気体の方がエントロピーが大きくなります。気体の方が、固体より「乱雑」なのです。
氷が溶ける反応は、吸熱反応なのに自然に起こるだろう?これはエントロピーが増加するためなんだ。一般的に、物質は散らばって存在している方が好きなんだよ。もう少しきちんと表現すると、エントロピーは増加しやすいということだ。
一箇所に集めた落ち葉、食卓のカレーライスの匂い、水の中に垂らした絵の具、だんだん広がっていくだろう?これも広い意味で「エントロピーの増加」というわけだ。

確かに、僕の部屋も、自然に散らかっていきます。これは自然の摂理だったんですね!
そうかもしれないね笑
エンタルピー変化(発熱か吸熱か)だけではなく、エントロピー変化(乱雑さ)も合わさって、化学反応が自然に起こるかが決まるわけなんだ。
5. ギブズエネルギーと反応の自発性(発展)
発展なんだけど、エンタルピーとエントロピー、両方の要素をまとめて判断するには『ギブズエネルギー』を使うよ。概要だけサクッと紹介しておくね。ギブスエネルギーは文字ではGで表し、次の式で表される。
ここでTは絶対温度(単位:ケルビン)を表します。
• ΔG<0:反応は自発的に進む
• ΔG=0:反応は平衡状態
• ΔG>0:反応は自発的に進まない
ちゃんと、判断する式があるんですね!
まとめ
「今日の授業を振り返ると、化学反応とエネルギーの関係には次のポイントがあったね。」
1. エンタルピーHは物質の持つエネルギーを表し、化学反応ではエンタルピー変化ΔHとして熱の出入りが起きる。
2. 発熱反応はΔH <0、吸熱反応ΔH>0。
3. 反応が自発的に進むかどうかは、エンタルピーHとエントロピーSのバランスで決まる。
4. (発展)ギブズエネルギーが負なら反応は自発的に進む。
エネルギーの出入りだけじゃなくて、乱雑さも関係しているのが面白いですね!
そうだね。次回は、エンタルピーの考え方を化学反応式に組み込むやり方を詳しく見てみよう!






