イオンとはいったい何でしょうか。原子とはどう違うのでしょうか。どのようにしてつくられるのでしょうか。
ここでは、イオンがどのようにしてつくられるかについて基本的なところから解説をしていきます。
イオンとは
博士、イオンというものがよくわかりません。
イオンは、電荷をもつ粒子のことだよ。簡単にいうと、プラスやマイナスの性質を持つ粒のことだ。詳しく見ていこうか。
原子の構造は覚えているかい?
陽子と中性子からできる原子核の周りを、電子が飛び回っています。
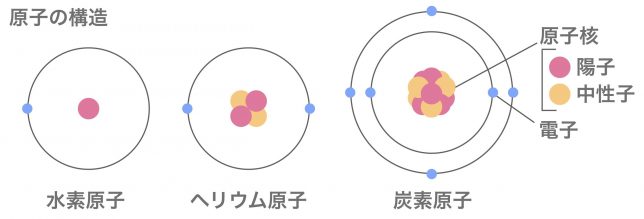
そうだね。
原子では、通常「プラスの性質を持つ陽子」と「マイナスの性質を持つ電子」は同じ数で釣り合っているんだが、何らかの原因によって、電子が増えたり減ったりすることがあるんだ。そうしてプラスマイナスのバランスが崩れた粒子がイオンってわけ。
プラスに偏る場合とマイナスに偏る場合が考えられますね。
そういうこと。
それぞれ陽イオン、陰イオンというよ。プラスイオン、マイナスイオンとは呼ばないから気をつけてね。
陽イオン
陽イオンの例として、ナトリウム原子がイオンに変化する様子を見てみよう。ナトリウム原子の陽子と電子の数はわかるかい?中性子はここでは影響がないので考えなくていいよ。
ナトリウム原子は陽子と電子がともに11個ですので、全体としてはプラスとマイナスが釣り合っていて、電荷はありません。
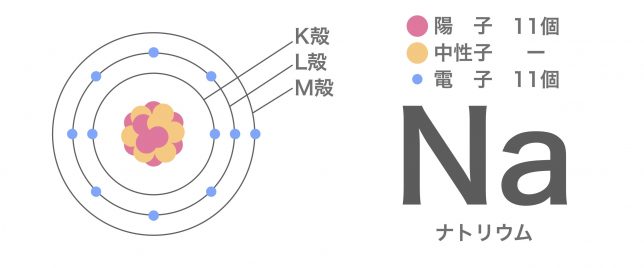
このとき、最外殻(NaではM殻)にある電子が何らかの原因によって放出されると、ナトリウム原子の電荷のバランスが崩れてイオンとなる。ナトリウムイオンの出来上がりだ。
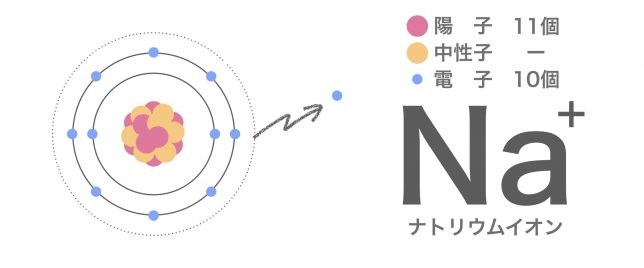
この場合、陽子が電子より多くなり、全体として正の電荷をもつため、ナトリウムイオンは陽イオンだね。元素記号の右上の+が目印だ。
M殻が消滅して、最外殻はL殻となりましたね。
ネオンNeと同じ電子配置になったね。
この電子配置は最外殻に原子が8個あり、非常に安定した形なんだよ。だからナトリウムはイオンになりやすいと言える。
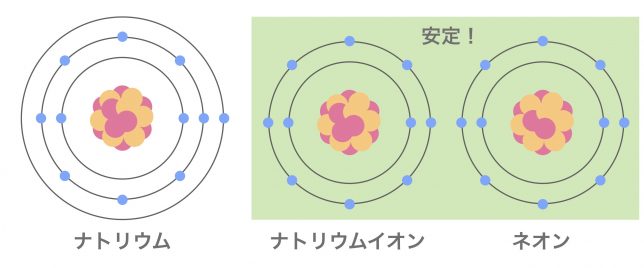
安定が好きなのは原子も同じなんですね。
陰イオン
次は陰イオンの例として、塩素原子がイオンに変化する様子を見てみよう。ナトリウム原子の陽子と電子の数は?
陽子と電子がともに17個で、電荷はやはり釣り合っています。
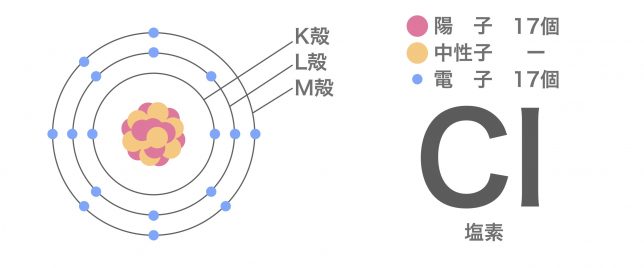
いまは、最外殻であるM殻には電子が7個入っているね。あと1個入って8個になると、先ほどの話でもあった安定した電子配置になれるんだ。これをオクテット則ともいうよ。
「オクト」は8を意味する言葉ですね。
オクトパス(たこ)は手が8本あります。
そこで、何らかの原因で電子が上手いこと入ってくると、塩素原子の電荷のバランスが崩れてイオンとなる。塩化物イオンというよ。
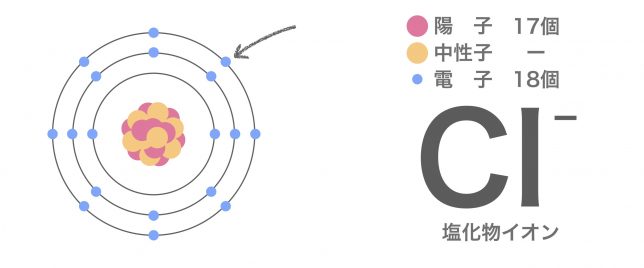
電子が陽子より多くなり、全体として負の電荷をもつため、塩化物イオンは陰イオンだね。元素記号の右上の−が目印だ。
「塩素イオン」ではないんですね。
陰イオンの場合は、一般に元の原子名が「○○素」の場合、「素」を抜いて「○○化物イオン」という呼び名になるんだ。
酸素だったら酸化物イオン、ヨウ素だったらヨウ化物イオンですね。
「硫黄」は例外的に「硫化物イオン」という呼び名になるから注意してね。
イオンの価数
次はイオンの価数についてだ。
マグネシウム原子が陽イオンになる様子を見てみよう。
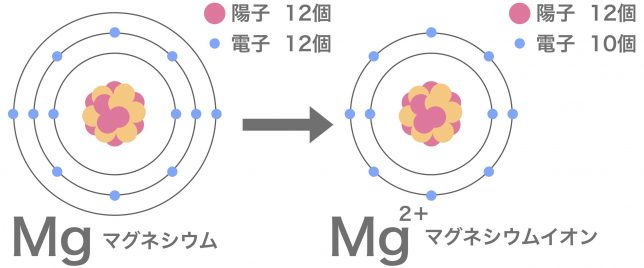
マグネシウム原子が安定した電子配置になるためには、電子が2つ取れる必要があるんですね。
そうすると、電子の数が陽子より2つ減るわけで、全体として+が2つ分あまることになる。
マグネシウムイオンは2価の陽イオンなんだ。
ということは、ナトリウムイオンは1価の陽イオンということですか?
そういうことだね。
原子がイオンになるときに放出したり受け取ったりした電子の数をイオンの価数というよ。プラスやマイナスの記号の前にその数字を書くことに注意しよう。
陽性と陰性
陽イオンになるか陰イオンになるかは決まっているんですか?
ある程度はね。
陽イオンになりやすい性質を陽性、陰イオンになりやすい性質を陰性というよ。
一般に、周期表の左下に存在する元素ほど陽性が強くて、右上に存在する元素ほど陰性が強いと言われているよ。
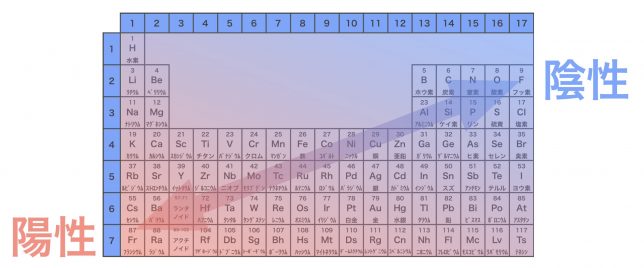
周期表の18族元素が消えていますね。
気づいたか。
18族元素(貴ガス)はもともと安定した電子配置だから、滅多にイオンにはならないから除外しているよ。
陽イオンになりやすい原子が陰イオンになることはないんですか?
いい質問だね。
陽イオンになりやすい原子が陰イオンになることがありえないわけではないんだ(逆もまた然り)。
しかし特殊な条件が必要なことがほとんどで、基本的には陽性の元素は陽イオンに、陰性の元素は陰イオンになると思ってもらっていいよ。
むむむ、とりあえず今はあまり深く考えないことにします。
ははは、まぁそれも大切かもしれないね。
✔︎イオンとは電荷をもつ粒子のことである。
✔︎正の電荷をもつ陽イオンと、負の電荷をもつ陰イオンがある。
✔︎イオンになる際に受け取ったり放出した電子の数を価数という。
✔︎陽イオンになりやすい性質を陽性、陰イオンになりやすい性質を陰性という。











