この世界にはたくさんの元素があり,原子どうしが繋がることによって数えきれないほどの化合物が存在している。原子やイオンといった小さな粒子どうしが繋がることを「化学結合」と呼び,いくつかのパターンがある。ここでは,化学結合の種類と特徴を見ていこう。
化学結合とは
化学結合がよくわかりません!
化学結合にはいくつかのパターンが存在するよ。化学結合には,まず「強い結合」と「弱い結合」があるんだ。強い結合は主に原子と原子の間ではたらき,弱い結合は主に分子と分子の間ではたらくよ。
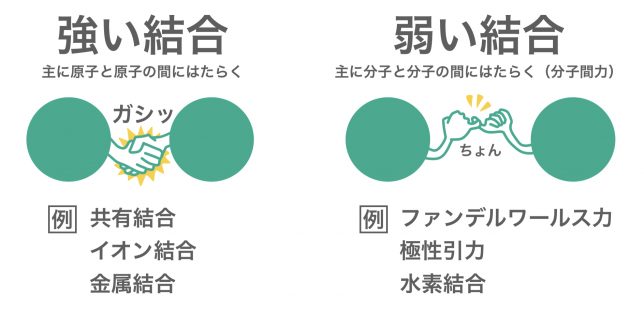
化学結合にはいくつかの種類が存在するが、それらの結合は「強い結合」と、「弱い結合」に大別される。「強い結合」の例としては「共有結合」「イオン結合」「金属結合」があり、「弱い結合」には「ファンデルワールス力」「極性引力」「水素結合」などがある。
強い結合は主に原子どうしの間で,弱い結合は主に分子どうしの間で形成される。
強い結合は結合が切れにくく、弱い結合は切れやすいんですか?
その通り。ちなみに,後者(弱い結合)は分子と分子の間にはたらくことが多いことから「分子間力」と呼ばれるよ。
強い結合
原子どうしの間に形成される強い結合には「共有結合」「イオン結合」「金属結合」があるよ。どの結合になるかは,繋がる原子が金属元素なのか非金属元素なのかである程度判断できる。
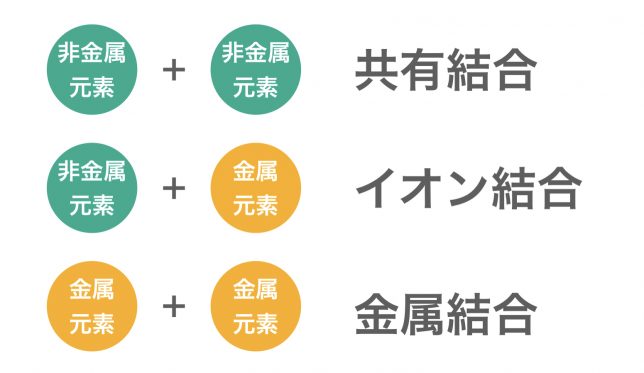
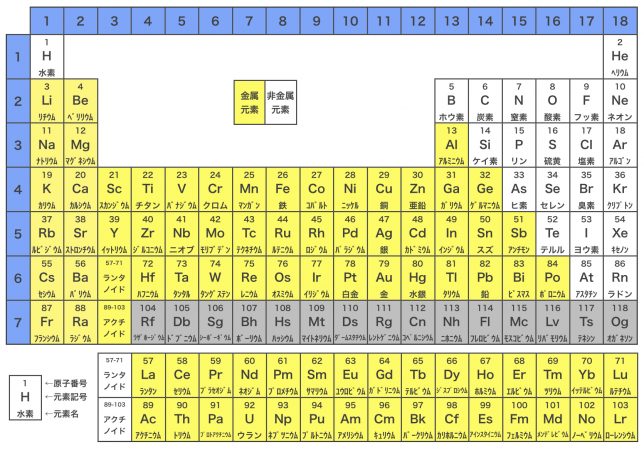
このように,非金属元素どうしが結合すると共有結合,非金属元素と金属元素が結合するとイオン結合,金属元素どうしが結合すると金属結合が形成される。なお,金属元素と非金属元素は周期表で以下のように分布している。
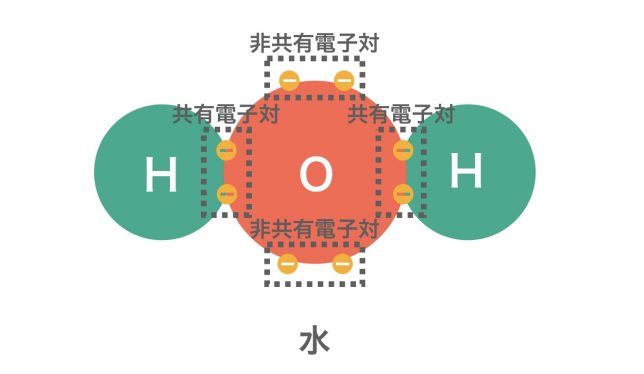
水分子H2O中のH原子とO原子は,非金属元素どうしですので共有結合ですね。
共有結合
共有結合は,非金属元素どうしが電子を出し合い,共有することで結合するよ。
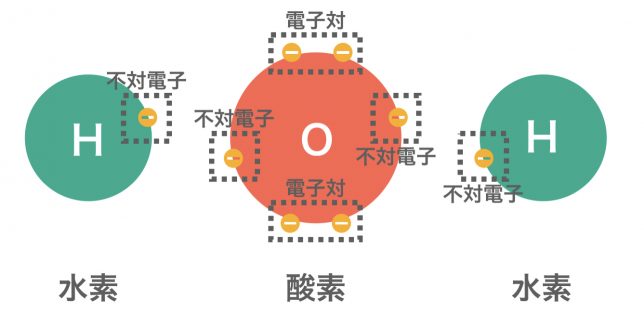
原子に存在する電子は,2個の電子が対をつくって1つの電子軌道に入ると電子対(でんしつい)となる。ここで,対になっていない電子を不対電子(ふついでんし)という。
非金属元素同士が不対電子を出し合い,共有して電子対を形成することで結合する結合が共有結合である。このときできる電子対を共有電子対と呼ぶ。このとき,共有していない電子対(元から電子対となっているもの)を非共有電子対と呼ぶ。
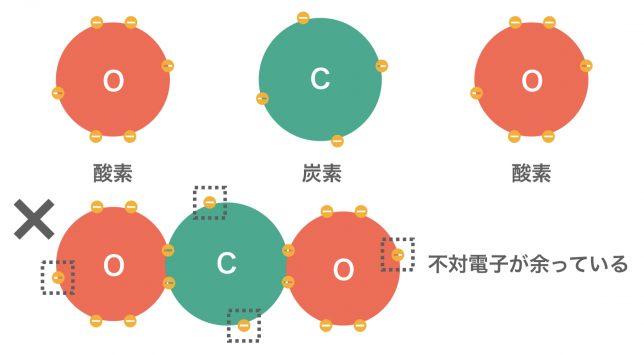
二酸化炭素CO2の場合はどうでしょうか。
二酸化炭素CO2をつくるとき、そのまま繋げてしまうと不対電子が余ってしまうね。これは良くない。不対電子が余らないように繋げなければならないんだ。
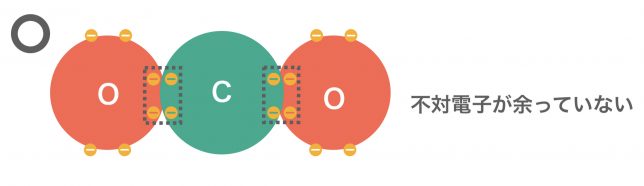
この場合、共有電子対2セットで結合させることによって、不対電子を無くすことができる。これを二重結合というよ。
イオン結合
陽イオンになった金属元素と陰イオンになった非金属元素の結合がイオン結合だよ。
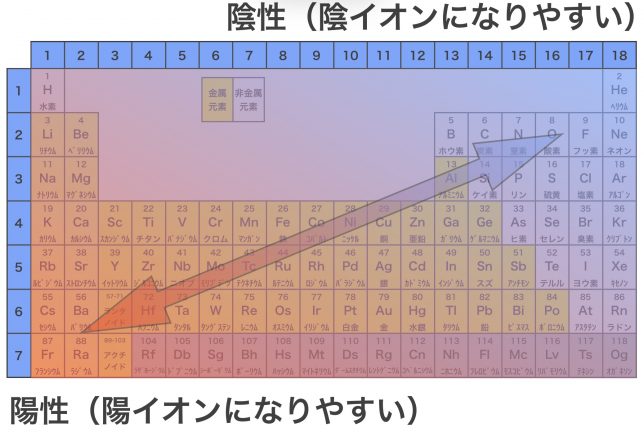
上の周期表を見るとわかるように,金属元素は陽性が強く,陽イオンになりやすい。非金属元素はその逆で,陰性が強くて陰イオンになりやすい。陽イオンとなった金属元素と陰イオンとなった非金属元素は,静電気的な引力(クーロン力)で引かれあい,結合する。これがイオン結合である。
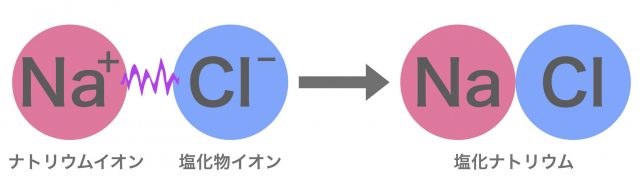
例えば,ナトリウムはナトリウムイオンになり,塩素は塩化物イオンになりやすい。+と−の間には静電気的な引力がはたらくので,結合して塩化ナトリウムとなる。この静電気的な引力はクーロン力とも呼ばれる。
詳しくは『イオン結合とは何か。組成式や名称の書き方は?』を読んでね。
金属結合
金属結合はその名の通り金属元素どうしの結合だよ。金属元素が自由電子によって結合していくんだ。

特定の原子に束縛されず,自由に動き回ってすべての原子に共有されている電子を自由電子という。金属結晶において,各原子の価電子は自由電子となっている。自由電子による金属原子間の結合を金属結合という。
1つの原子に留まらず、自由に動き回るから自由電子なんですね。
金属の5大性質は全てこの自由電子で説明できるんだよ。

金属の5大性質は上の5つであるが,自由電子が動き回ることで熱や電気を伝えているのである。また,自由電子により光が反射されることは金属光沢として観測される。自由電子は結合の角度が固定されないため,形を変えることができ,延性や展性をもつ。
弱い結合
弱い結合は分子と分子の間にはたらくため「分子間力」と呼ばれ、「ファンデルワールス力」「極性引力」「水素結合」などがあるよ。
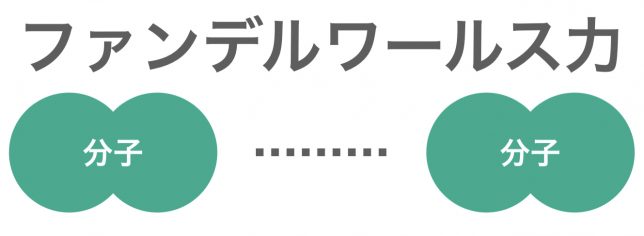
ファンデルワールス力は,すべての分子間にはたらく弱い引力である。構造が似ている分子では,分子量が大きいほどファンデルワールス力は大きくなり,分子から成る物質の沸点も高くなる
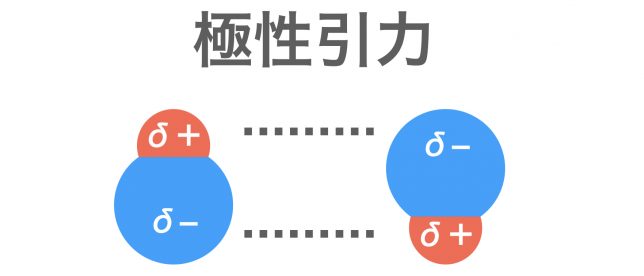
+−の偏りがある分子(極性分子)どうしの間には,静電気力がはたらく。この力が極性引力である。極性引力に加えてファンデルワールス力もはたらくため,分子間の結合はファンデルワールスのみの場合に比べて強くなる。
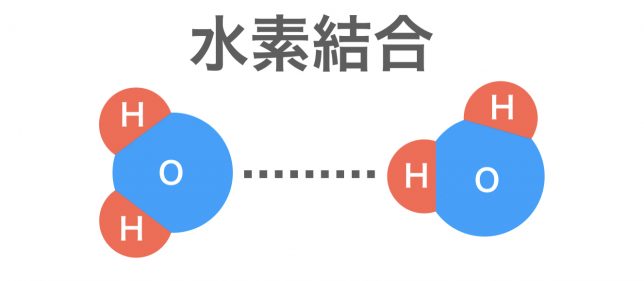
水素原子Hが弱い正電荷をもち,電気陰性度の大きな原子(主に窒素N,酸素O,フッ素F)が弱い負電荷を帯び,これらの原子間で生じる静電気的な引力が水素結合である。水素結合は弱い結合の中では強く,ファンデルワールスの10倍程度は強いと言われている。
水分子H2Oの中のH原子とO原子は原子どうしの強い結合「共有結合」で、水分子どうしの間のH原子とO原子間の結合が弱い結合「水素結合」ということですね。
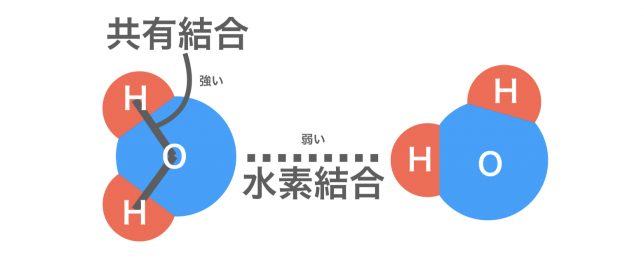
分子間力はあくまでも分子と分子の間の力である。各分子内の結合は上で説明した強い結合であるので注意。
分子間力の強さは状態変化のしやすさに大きく影響を及ぼす。この力が強くはたらくほど沸点や融点が上がる傾向があるよ。詳しくは『物質は固体・液体・気体の三態の間で変化をする』を参考にして欲しい。
✔︎ 化学結合には強い結合と弱い結合がある。
✔︎ 強い結合は原子間で,弱い力は分子間ではたらく。
✔︎ 強い結合には共有結合,イオン結合,金属結合がある。
✔︎ 弱い結合にはファンデルワールス力,極性引力,水素結合などがある。