化学結合の一種である共有結合は、非金属元素同士の結合のことを指す。この際、異なる2種類の原子が結合する場合、共有電子対はふつうどちらかの原子の方へかたよる。これによってどのようなことが起こるかを考えていく。
共有結合は全て同じ?
共有結合の復習だよ。水素H2と塩化水素HClの電子式はどうなっているか書けるかな?

こうなります。水素も塩化水素も共有電子対「:」1セットによる単結合です。

それでいいよ。
共有結合は、不対電子「・」を結合の手🖐️として繋げて、共有電子対「:」🤝となるイメージだったね。例えば、塩化水素だとこんな感じだ。
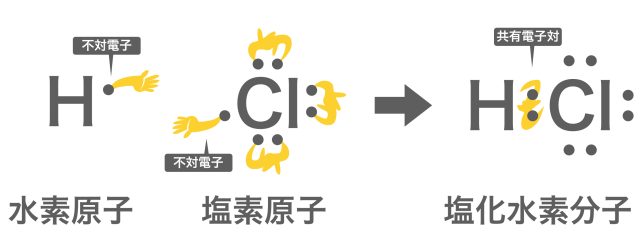
共有結合は結構がっしりとした強い結合でしたね。
はじめの問題では、水素分子H2も塩化水素分子HClも不対電子1つずつによる単結合で、どちらも同じような結合に見えるね。
しかし、この2つの分子で形成されている結合には違いがあるよ。なんだか分かるかな?
同じ元素どうしの結合(HとH)か、違う元素の結合(HとCl)か、ですか?
そうそう。当たり前のことなんだけど、これは結構大切なことでね。
共有結合は、先ほどの通り不対電子「・」を結合の手🖐️として繋げて、共有電子対「:」🤝となるイメージなんだけど、この手の強さは、元素の種類によって異なっている。
原子が共有電子対を引き付ける強さを電気陰性度といって、元素によって大きさが違うんだよ。
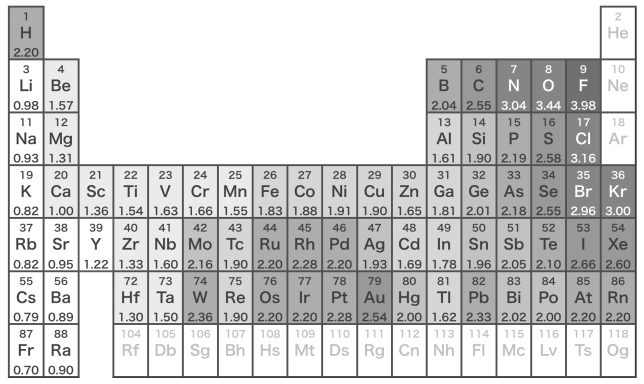
電気陰性度の値(Paulingの値)。周期表の右上ほど大きく,左下ほど小さい傾向がある。
これを見ると、フッ素Fの値が3.98で一番大きく、フランシウムFrが0.70で一番小さいですね。水素は2.20で平均的な値ですが、塩素Clは3.16でかなり大きな値です。
これを踏まえて、水素Hと塩素Clの結合の手🖐️をイメージをし直すと、こんな感じだよ。
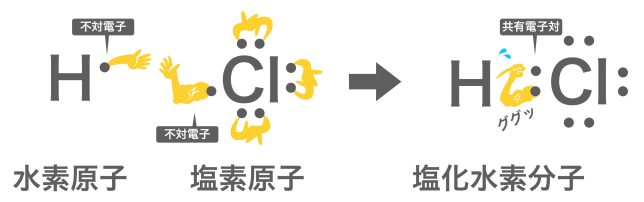
塩素の結合の手、ムキムキですね!
極性のある結合
電気陰性度が大きいということは、結合の手の力が強いイメージなんだ。
塩化水素では塩素の方が共有電子対「:」を引き付ける力の強さ(電気陰性度)が強いため、塩素原子Clの方に共有電子対が引き寄せられていますね。
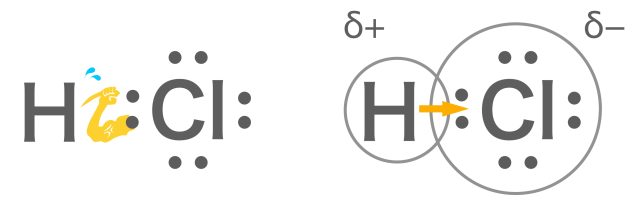
その通り。これを、極性と呼ぶよ。
反対に、極性がない場合は無極性と呼ぶんだ。
塩化水素分子HCIでは、電気険性度の大きなCl原子が共有電子対を引きつけるので、CI原子はわずかに負の電荷(−)を帯びH原子はわずかに正の電荷(+)を帯びている。(δデルタ)は「少しだけ」の意味である。このような、共有結合における電荷のかたよりを極性と呼ぶ。異なる2種類の原子同士の結合では、電気陰性度の違いから、ふつう極性が生じる。反対に、H2のように同じ原子同士の結合では極性は生じない。
極性分子と無極性分子
分子全体で極性のある分子を極性分子、無い分子を無極性分子というよ。
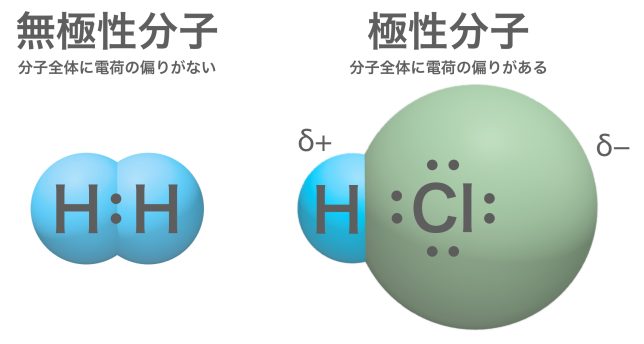
水素分子H2は無極性分子、塩化水素HClは極性分子ということですね。
同じように考えていくと、酸素O2は無極性、フッ化水素HFは極性分子ですね。
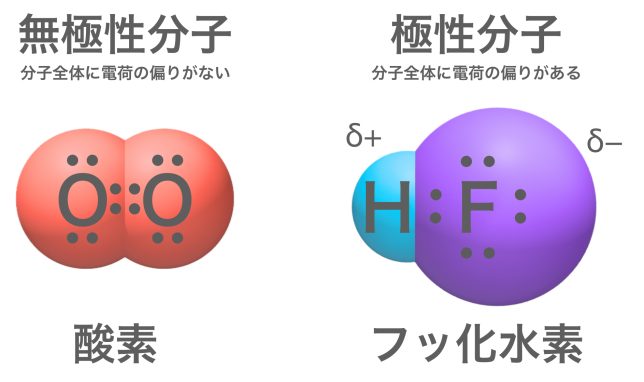
それでいいよ。じゃあ二酸化炭素CO2はどうかな。

ええと、炭素Cと酸素Oで異なる原子だから極性分子ですね!
残念。二酸化炭素CO2は無極性分子なんだ。二酸化炭素の分子はO=C=Oと一直線に並んでいて、共有電子対を引っ張る力が釣り合ってしまうんだ。綱引きの要領だね。このように、分子の形によっては極性が打ち消されてしまうことがあるよ。
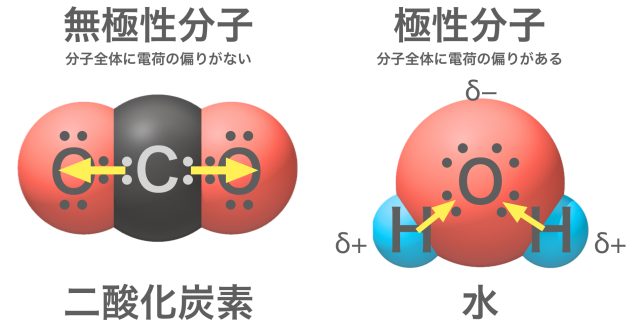
3つ以上の原子からなる分子の極性は、それぞれの結合の極性だけではなく分子の形を考える必要がある。二酸化炭素分子O=C=Oには極性のある結合C=Oが2つあるが、分子が直線形であるので、結合の極性の方向が正反対で互いに打ち消しあう。そのため、分子全体としては極性がなくなるので無極性分子といえる。水分子H2Oにも極性のある結合HーOが2つあるが、分子が折れ線形をしているので、結合の極性が打ち消されず、分子全体としても極性がある。
分子の形も考える必要があるんですね。
分子の形がどうなっているかは別の記事で紹介しているよ。
極性分子と無極性分子の特徴
極性分子と無極性分子では、当然ながら性質が異なるよ。
以下の2点については覚えておくと便利だよ。
極性分子は同じ極性分子である水に溶けやすい性質を持っている。例えば、塩化水素HClは水に非常によく溶けるが、無極性分子である水素H2や酸素O2はあまり溶けない。
極性分子は分子内で極性による引力が生じているので、無極性分子より融点や沸点が高い傾向がある。例えば、極性分子である塩化水素HClの沸点は常圧で約−85℃であるが、無極性分子である酸素O2の沸点は約−183℃である。
共有結合とイオン結合
結合の極性・無極性については、共有結合(非金属元素同士の結合)の話ですよね?先ほどの電気陰性度表に金属元素の値が書いてありますが、どういうことでしょうか。

電気陰性度の値。中央付近から左下の方の元素は金属元素である。
鋭いね。
金属元素の電気陰性度の値は軒並み小さいだろう?結合する原子間の電気陰性度に大きな差があると、電子がかたよるどころか、完全に引っこ抜かれてしまうんだ。例えばナトリウムNaと塩素Clの結合を考えてみよう。
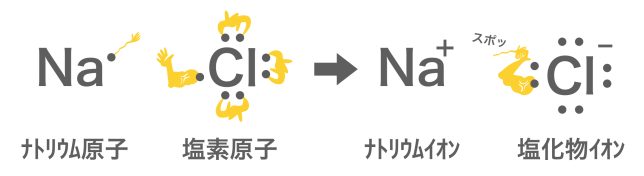
ナトリウムの手がひょろひょろで塩素に引っこ抜かれてしまいました!
ということはNaとClは結合できないのでしょうか?
結合の手というのは電子(不対電子)だったね。
電子を抜かれたナトリウムはナトリウムイオンNa+に、引っこ抜いた塩素Clは塩化物イオンClーになり、今度は+とーの静電気的な引力(クーロン力)によって結合するようになるよ。これがイオン結合だ。
一般に、電気陰性度の差が2を超えてくると、結合は共有結合性ではなくてイオン結合性になってくるよ。

共有結合とイオン結合は全く別の結合だと思っていましたが、意外な関係があるんですね。
✔︎ 共有結合には、結合する原子の電気陰性度の違いから「極性のある結合」と「無い結合」がある。
✔︎ 分子には極性分子と無極性分子がある。分子の形を考える必要がある。
✔︎ 電気陰性度に差があると結合はイオン結合性となる。






