物質は,様々な種類の原子どうしが結合してできる。非金属元素どうしの結合では,原子の最外殻に存在する電子が大きく関与する。このことから,最外殻に存在する電子を可視化した電子式を用いることで,結合の様子を分かりやすく記すことができる。ここでは電子式の特徴を見ていこう。
電子対と不対電子
元素記号の周囲に,最外殼電子(1番外側の電子殻にある電子)を点「・」で表した式を電子式というよ。例として,いくつかの原子について,電子式を見てみよう。
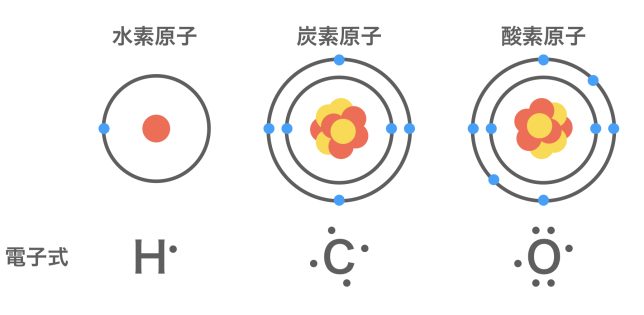
最外殻電子はできるだけ元素記号の上下左右の4ヶ所に分散して入るようにする。このとき,「 : 」「・・」のように対になったものを電子対,対になっていないものを不対電子というよ。
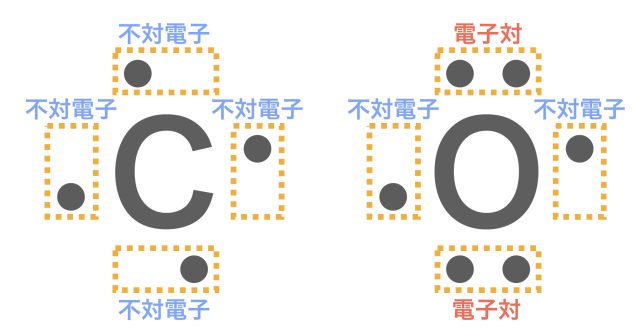
最外殻電子が5つ以上だと,電子対ができるわけですね。
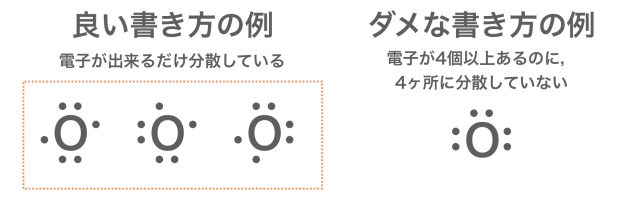
ちなみに,電子式の書き方はルールを守っていれば,書き方はいくつか考えられるものもある。酸素原子の電子式で例をあげると,次のようになるよ。
電子式のメリット
書くのが面倒にも思える電子式を書くメリットは,結合の様子を分かりやすく記すことができること。

電子式を書いたときの不対電子「・」は結合の手✋と考えることができる。上の図のように,水素原子からは1本,炭素原子からは4本の手が伸びていると考えられる。酸素原子は最外殻電子が6つであるが,そのうち4つは電子対「・・」となり,安定化しているので結合に関与しにくい。結合の手同士でペア🤝になっているとイメージすると良い。よって酸素の結合の手は2本と考えることができる。この結合の手のことを「価標」と呼ぶ。
一番外側に存在する最外殻電子が結合に関与すると考えるんですね
さて、手を繋いでいくイメージで結合を考えてみよう。水素原子2つと酸素原子1つはどのように繋がるかな?
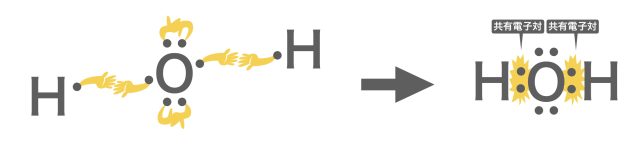
共有結合については,別の記事でも扱っているので,合わせて確認しておきましょう。
さまざまな電子式
ここで問題だよ。
問 次の分子を電子式で示せ。
⑴ アンモニア NH3 ⑵ 二酸化炭素 CO2 ⑶ シアン化水素 HCN
⑴のアンモニアは,窒素原子と水素原子の電子式を書いて,こうですね
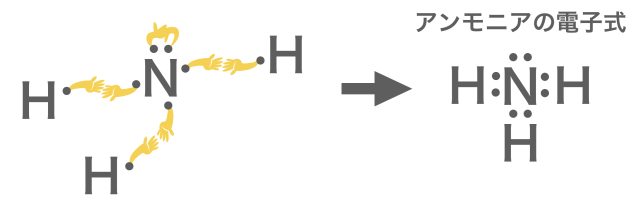
⑵と⑶は,1本ずつではうまく手が繋がりませんね
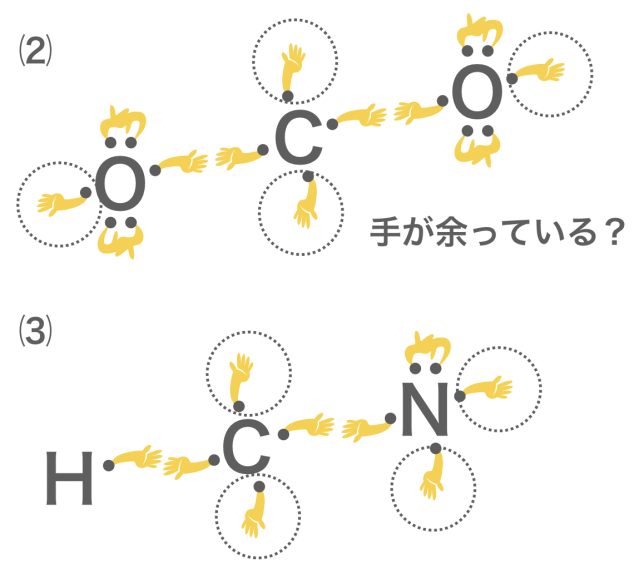
価標(結合の手)は余らないように繋がないといけないよ。1本で余るなら,2本や3本で繋げてみよう。それぞれ二重結合,三重結合というよ。
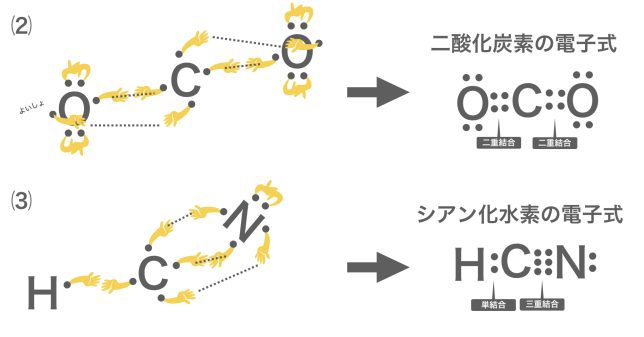
点を書くときはしっかり書こうね
電子を可視化できると
電子式は書くのがやはり手間ですね
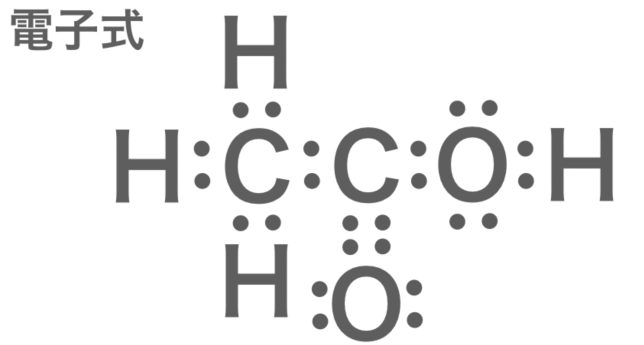
酢酸の電子式。すでにややこしい。
大きい分子ほど場所を取るし,そこまで書く機会が多いとは言えないけど,電子を可視化することでメリットもあるのが電子式だね。たとえば分子の形を考える時にも使えるよ。
✔︎ 化学式には様々な書き方が存在する。
✔︎ 電子式は最外殻電子を「・」で表した式。
✔︎ 電子式を書くと,結合の様子を知ることができる。









