水素原子2つと酸素原子1つからなる水分子H2Oは,折れ線形をしています。酸素原子を中心として,2つの水素原子が角度をつけて繋がっているのです。これは,世界中のどの水分子でも同じ形をしており,折れ曲がっている角度まで決まっています。分子の形はどの様に決まっているのでしょうか。ここではその仕組みについて見ていきます。
水分子の形
博士,水分子H2Oの形についてなのですが…
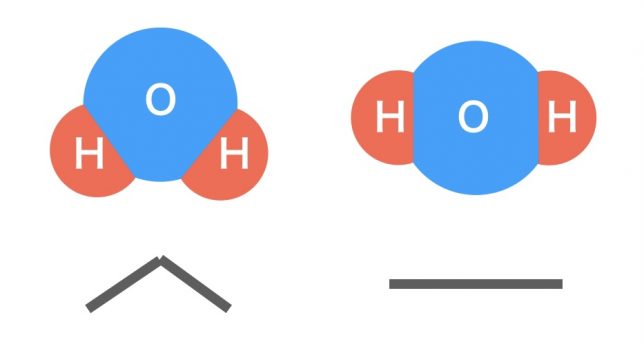
分子の模型がたびたび登場するのですが,どれを見ても,左の様に折れ曲がった形で描かれています。右の様に,真っ直ぐ描いてはダメなのですか?
実際の水分子が折れ線形の構造といって,折れ曲がって繋がっているからね。
でも,構造式で書く場合は真っ直ぐ書いてあることが多いですよね。

構造式は,結合の様子を平面的に示したもので,実際の形を正確に表す必要はないんだ。
もちろん,曲げて書いても×ではないよ。
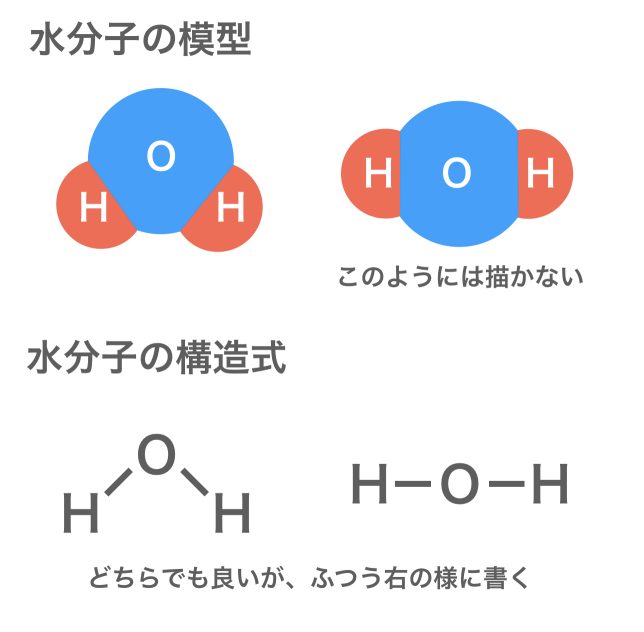
分子には、決まった形をもつものがある。例えば水分子は上記の様に折れ線形をしており、その角度はおよそ104.5°である。このことは、水の性質にも大きく関わってくるので、模型として表すときはその形を意識して描かれる。しかしながら、構造式は結合の様子を平面的に記したものであるので、実際の形と異なる書き方となってしまうことが多い。
 | HGS分子構造模型 A型セット 有機化学入門用 [ 丸善出版 ] 価格:2200円 |
高校から大学の授業でよく使われる、定番の分子模型です。
さまざまな分子の形
水分子以外で形が決まっている分子は,どんなものがあるんですか?
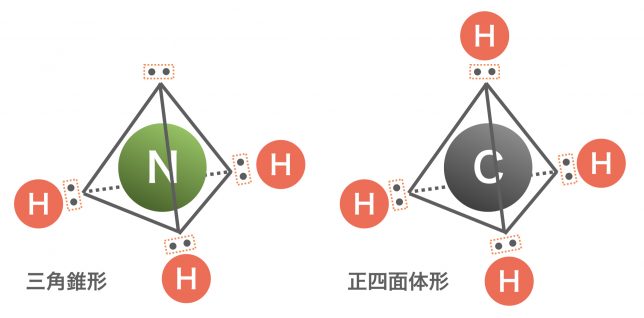
そうだね,有名なものを紹介すると,アンモニアの三角錐形,メタンの正四面体形,二酸化炭素の直線形がある。
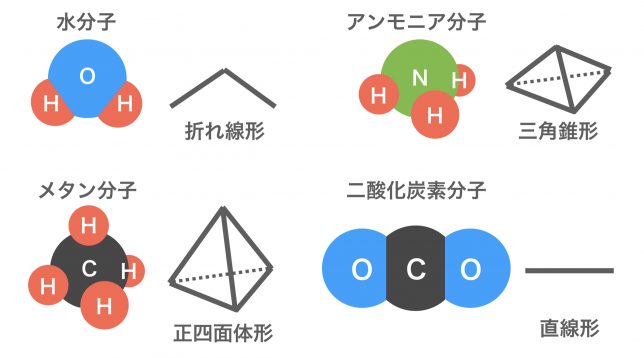
こういった比較的簡単な分子は,決まった形になることが多いね。
逆に,複雑な構造になってくると,分子の形がひとつに決まらなくなってくる。
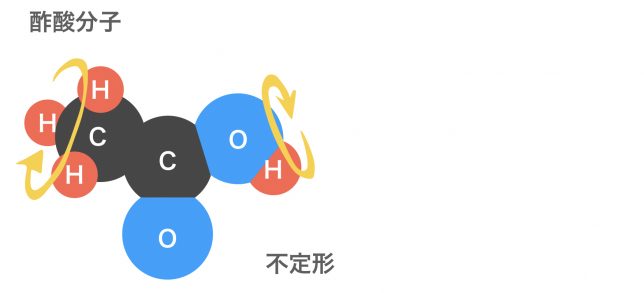
酢酸分子CH3COOHは、分子の中に可変領域をもつ。したがって,全ての酢酸分子が同じ形とはならない。原子の繋がりかたは同じであっても,その結合方向が動くためである。このように,複雑な分子ほど決まった形とはならなくなっていくことが多い。形がひとつに決まっている分子の数は,決まっていない分子の数よりずっと少ない。
形が決まっている分子は,全て覚えるべきですか?
有名なものは覚えておくといいんだけど,全て覚える必要は全くない。
むしろ,知らない分子についても,実はある程度予想することはできるから,その考え方を知っておく方がいいよ。
分子の形を予想するには,電子式が書ける必要がある。忘れてしまった人は復習しておこう。
分子の形を予想する
まず,水分子を電子式で書いてみよう。
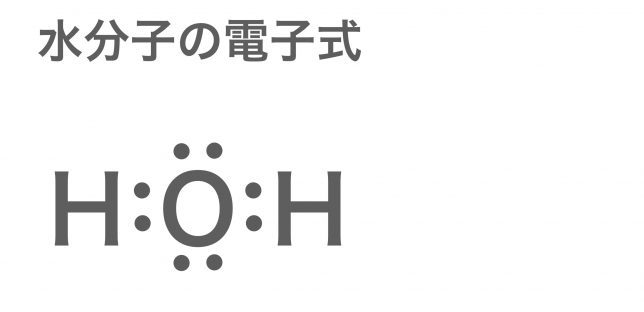
こうですね。
さて,中心の酸素原子に着目すると,そのまわりに電子対が4セットあるね。
電子はマイナスの性質をもっているから,電子対どうしは反発すると考えると,4セットの電子対は,酸素原子のまわりで正四面体の頂点方向に位置したときに安定する。
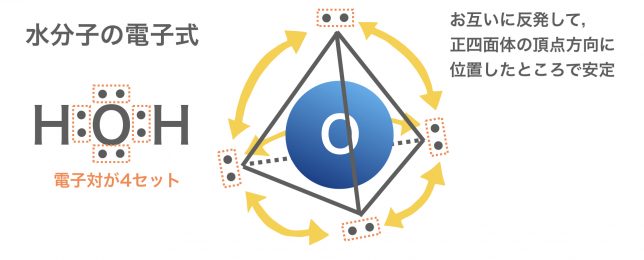
球のまわりに4つのお互いに反発するものが存在する場合、正四面体の頂点方向に位置したときに一番安定となる。これは、反発するものどうしがなるべく遠ざかろうとした結果、距離が全て等しくなるところで安定するからである。以上のことを踏まえると、酸素原子を球とみなした場合、4つの電子対は正四面体の頂点方向に存在していると考えることができる。
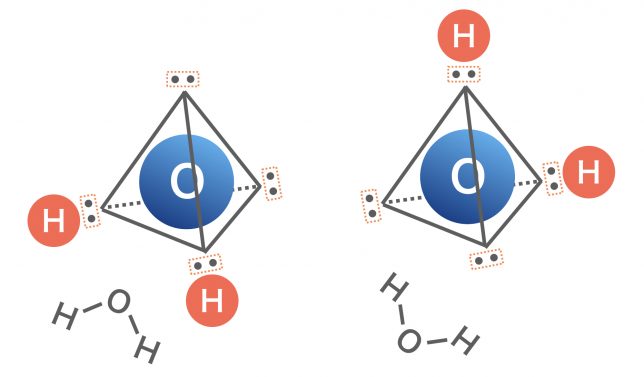
この電子対のうち,2つに水素原子がくっつけば水分子が完成だ。どこの2つを選んでも,折れ線形になるだろう?
アンモニアNH3やメタンCH4についても,同様に考えることができるよ。やってごらん。
まずは電子式を書いて中心の原子を決めると,アンモニアは窒素Nで,メタンは炭素原子Cですね。そのまわりには,どちらもやはり電子対が4セットあります。
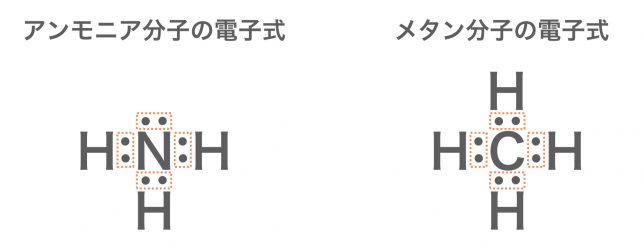
ということは,正四面体の頂点方向に電子式が位置するパターンだね。窒素のまわりに3つ水素がつけばアンモニア,炭素のまわりに4つ水素がつけばメタンとなる。
二酸化炭素はどうなるんですか?

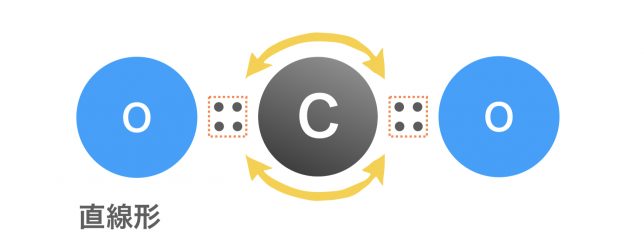
二重結合の関係で,反発する電子対は4セットではなく2セットになるね。
二重結合の場合,電子4つ(電子対2セット)でひとまとまりと考えるわけですね。
そうなると,球のまわりで正反対に位置したときに最も安定となるね。
そこに酸素原子がつながれば,直線形の二酸化炭素分子となるわけだ。
電子式が書けると,確かにある程度分子の形を予想できますね。
実は本当はもう少し複雑なんだけどね。まぁ簡単に予想する方法だと思って知っておくと良いね。
✔︎ 分子の中には,形がひとつに決まっているものがある。
✔︎ 分子の形は,電子対の位置である程度予想できる。











