物質の最小単位は原子ですが、原子の構造を見ると、さらに小さな3種類の粒子からできていることがわかります。
その3種類の粒子(電子・陽子・中性子)について詳しく見ていきましょう。
原子の構造
さっそくだけど、今日は原子の構造を見ていくよ。
原子は、これ以上分割できない微粒子でしたね。
そうだね、確かに物質の最小単位は原子だ。しかし、その原子はさらに3種類の粒子からできているんだよ。
ええ??
これ以上分割できないんじゃなかったんですか?
その原子の構造は、電子・陽子・中性子という3種類のさらに小さい粒子からできているんだ。そういう意味ではまだ小さくなるね。
電子・陽子・中性子
一般的な水素原子Hとヘリウム原子Heと炭素原子Cの構造を見てみよう。
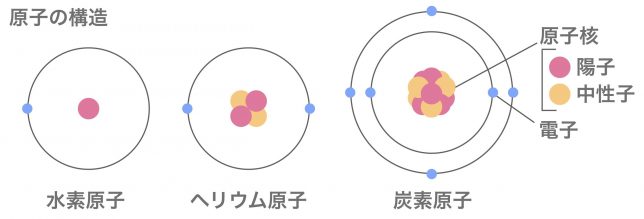
陽子や中性子が真ん中にあって、その外側に、電子があるんですね。
真ん中の陽子と中性子の集まりを原子核というよ。この水素原子の場合は陽子ひとつで原子核だね。
元素(原子の種類)は100種類以上ありましたが、元素によって電子・陽子・中性子の数が変わるんですね。
そうだね。
この数の違いによって様々な原子の性質が生まれるんだ。それぞれの粒子の特徴を詳しく見ていこう。
電子
電子はマイナスの性質をもつ小さな粒だよ。
カッコよく言うと「負の電荷をもつ粒子」だ。原子核の周りを飛び回っている。

水素は1個、ヘリウムは2個、炭素は6個といった具合になっているますね。
あ!原子番号と一緒です!
よく気がついたね。電子の数は化学結合に影響し、その元素の性質を決めるんだ。だから、原子ではこの数が原子番号となるんだよ。
陽子
マイナスの粒子があると言うことは、プラスの粒子もありそうですね。陽子というのがそうですか?
鋭いね。
陽子は電子とは反対でプラスの性質をもつ粒だよ。つまり「正の電荷をもつ粒子」だ。

原子ではプラスとマイナスが釣り合っているから、陽子数=電子数となるよ。
ということは、電子数=陽子数=原子番号ですね。
中性子
陽子がプラスで、電子がマイナス…では中性子は何ですか?
中性子はプラスもマイナスもない粒で、「電荷をもたない粒子」と言われるよ。

うーん、何のために存在しているんですか?
中性子は陽子同士をくっつける接着剤のような役割をもっていると思っておけばいい。陽子どうしはプラスどうしで反発してしまうからね。
なるほど。陽子同士の間を取り持ってくれる存在なのですね。
中性子の数は同じ元素でも変わることがあるよ。あと、水素原子は陽子がひとつしかなくて反発しようがないから、例外的に中性子が無くてもいいよ。
質量数
電子は陽子や中性子よりもさらに小さくて軽いんだ。陽子と中性子はほぼ同じ質量なんだけど、電子はその1840分の1ほどしかないよ。
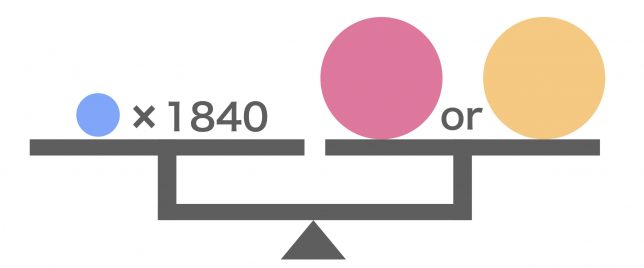
ということは、原子の質量はだいたい陽子と中性子の和、つまり原子核の質量と考えてよさそうですね。
そうだね。
陽子と中性子の数の和を質量数というよ。陽子と中性子の質量は1(単位なし)としているよ。
例えば、炭素原子(陽子6個、中性子6個、電子6個)の原子番号は6、質量数は12といった感じですか?
それで良いよ。
ちなみに、記号と数字を使って、このように書くことができるよ。
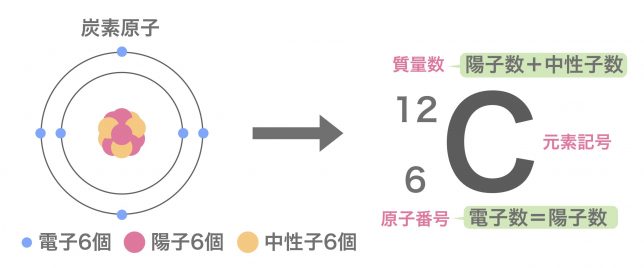
元素記号の左下に小さく原子番号を書き、左上に小さく質量数を書くんだ。この書き方で、その原子がもつ電子と陽子と中性子の数が全てわかるね。
左下の数字を見れば陽子と電子の数が分かり、左上の数字から左下の数字の差が中性子の数ということですね。
そういうことだね。
だいたい分かったようだね。
数字を書く位置を間違えないように注意します。
✔︎原子は電子・陽子・中性子の3種類の粒子からなる。
✔︎電子は負の電荷をもつ粒子で元素の性質を決める。
✔︎陽子は正の電荷をもつ粒子で電子の数と一致する。
✔︎中性子は電荷を持たない粒子で陽子同士をつなぎとめる。
✔︎陽子数+中性子数を質量数という。











