電子の存在場所
博士、原子の構造について質問してもいいですか?
いいよ。どうかしたかい?
原子は中心に陽子と中性子からなる原子核があって、その外側を電子が飛び回っていると学びました。
ふむ。そうだね。
原子核はいいとして、電子が飛び回っているとはどういうことですか?
なるほど。確かに不思議だよね。
そうだね、イメージすると、地球と月みたいな関係かな。
どういうことですか?
地球の重力に引っ張られて、月は地球の周りを回っているでしょ?
同じように中心の陽子のもつプラスの力(正の電荷)に引っ張られて、マイナスの力(負の電荷)をもつ電子が飛び回っているんだよ。
何か原子が小さい天体に思えてきました。
複数個の電子をもつ原子でもそうなんですか?
そうだね。原子核の周りには原子番号と同じ数の電子が高速で回っているんだ。
原子番号1番の水素原子Hでは1個、2番のヘリウムHeでは2個、6番の炭素原子Cでは6個の電子が飛び回っているよ。構造を少し図で書いてみよう。
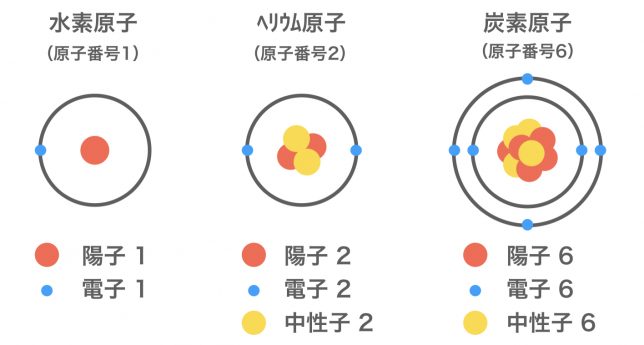
原子の中心には,正の電荷をもつ陽子と電荷をもたない中性子からなる原子核があり,その周りを負の電荷をもつ電子が高速で飛び回っている。陽子の数と電子の数は原子番号と一致している。(中性子の数は同位体が存在する関係上,その数は変動することもある)電子の分布については,上のように断面図で描かれることが多いが,実際には原子核をつつみ込むように球状に広がって存在する。
電子殻とは
あれ?
炭素原子Cの6個の電子は2個と4個の2層に分かれて飛び回っているんですか?
電子は一定数個がグループをつくって原子核の周りをいくつかの軌道に分かれて運動しているよ。この軌道を電子殻といって、電子殻には内側からK殻、L殻、M殻…というように名前がついている。
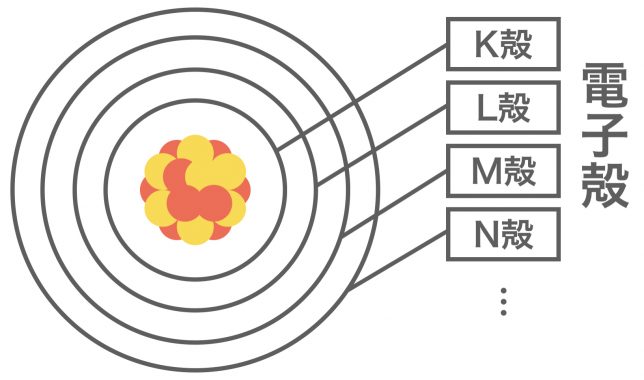
原子の中の電子は,原子核の周囲にいくつかの層をなして存在する。これを電子殻と呼び,原子核に近い方から順にK殻,L殻,M殻…というように名前が付けられている。
Kからアルファベット順になっているんですね。Aからにすれば良いのに。
まぁ、電子殻が発見された当時は、もっと内側に軌道があると思われてて、A〜Jまでの10軌道ぶん余裕を設けてあったと言われているよ。
だいぶ自信なかったんですかね。
話を戻そう。
先ほどの電子殻だが、その軌道の中に入ることができる電子の最大数は電子殻ごとに決まっていることを覚えておいてほしい。K殻は2個、L殻は8個、M殻は18個…というようになっているよ。
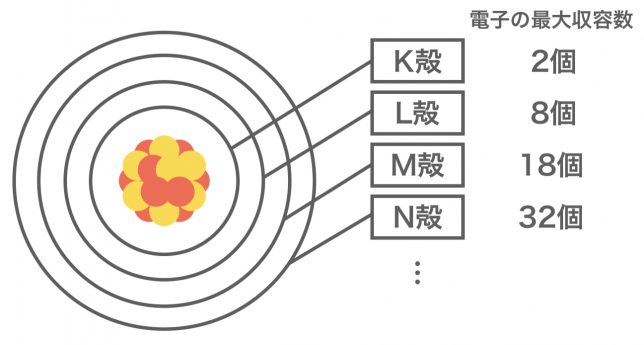
内側から外側に向かうにつれて、入ることのできる電子の最大数が増加するんですね。
殻が大きくなっていくからね。
ちなみに、内側からn番目の殻には2n2個の電子が入ることができるんだ。
L殻は中心から2番めですから、2n2のnに2を入れたら、確かに8個になりますね!
電子配置
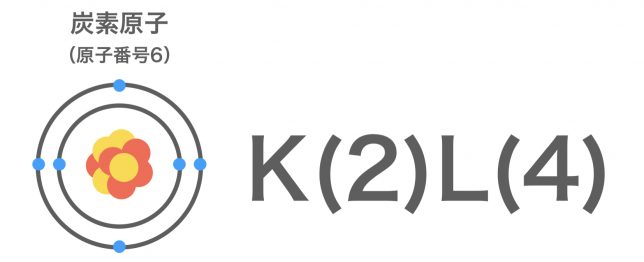
では、先ほどの炭素原子Cの電子は、K殻に2個、L殻に4個入っていると表現できますね。
そうだね。
電子の入り方(配置の仕方)のことを電子配置というんだ。炭素原子Cの電子配置はK(2)L(4)と書いて表現するよ。K殻に2個、L殻に4個入っているという意味だ。
K(1)L(5)のようになったりはしないんですか?それぞれの電子殻の最大数は超えていないですよ。
電子は、基本的には内側の電子殻から順番に入っていくんだ。そしてその電子殻がいっぱいになると、外側に次の殻ができてそこに入っていくと覚えておこう。
炭素原子Cは6個の電子がありますから、K殻に2個入ったらこれ以上K殻に入れないのでL殻ができて、残りの4個がそこに入るのですね。
そういうこと。
これ以上電子が入れないことを「閉殻状態」というよ。K殻は2個で閉殻、L殻は8個で閉殻だね。先ほどの2n2個の話を思い出そう。
電子の椅子取りゲームみたいですね!
確かにね。
では問題だ。原子番号18番の元素アルゴンArの電子配置は?
ええと、電子は原子番号と同じ18個で、内側のK殻から順に入っていきますから…
K(2)L(8)M(8)ですね!
大正解。だいたい理解したようだね。
最外殻電子と価電子
あと、電子配置の話の中で知っておいてほしい言葉が2つあるよ。最外殻電子と価電子という言葉だ。
最外殻電子は言葉通り1番外側の殻にある電子のことですか?
その通り。例えば、先ほどのアルゴンで言えば最外殻はM殻で、最外殻電子は8個だね。
では、価電子とは何ですか?
価電子は化学結合に大きく影響する電子のことだよ。結合は一番外側が影響を強く受けるため、通常は最外殻電子が価電子に該当するよ。
ということは、アルゴンの価電子は最外殻電子と同じで8個ですね。
いや、アルゴンのような貴ガス元素の場合は価電子は0個とするんだ。
え?何でですか?
貴ガス元素(ヘリウムHe、 ネオンNe、アルゴンAr、クリプトンKr、キセノンXe、ラドンRn)は、とても安定した電子配置となっていて、結合をあまり作らないからだよ。

なるほど、価電子は化学結合に大きく影響する電子のことですもんね。結合しないなら最外殻にいくつ電子があっても0ですね。
そういうこと。
よし、今日はここまでにしようか。
✔︎電子は,原子核の周囲に存在する電子殻に収容されて飛び回っている。
✔︎電子殻は中心からK殻,L殻,M殻…と名前がつけられており,最大収容数も決まっている。
✔︎一番外側の電子殻を最外殻といい,そこに含まれる電子を最外殻電子という。
✔︎価電子は最外殻電子のことを指すことが多いが,貴ガスの価電子は0個となる。







