「物質量」とは、化学の計算や反応を考える上で欠かせない重要な概念です。しかし、「モル」や「アボガドロ数」といった言葉に戸惑いを感じる人も多いかもしれません。物質量は、目に見えない原子や分子の数を数えるための便利な方法で、質量や粒子の数と密接に関係しています。この授業では、物質量の基本的な考え方や計算方法をわかりやすく解説していきます。
物質量って何?
今日は「物質量」という大事なテーマを扱うよ。「物質量」って聞いたことあるかな?
理科の授業で「モル」という単位を使った計算をやったことがあります。でも、なんだかよくわからなかったです……。
なるほど。「モル(mol)」と「物質量」はとても重要な概念だけど、確かに最初はわかりにくいかもしれないね。じゃあ今日は、モルって何なのか、どうやって使うのかを丁寧に説明していくよ。
まず、物質量っていうのは、簡単に言うと「どれだけの粒があるか」を表す量なんだ。粒っていうのは、原子や分子みたいなとても小さい粒子のことね。でも、原子や分子はあまりにも小さくて、1つ1つ数えるのは現実的じゃないよね?

確かに、そんなに小さい粒を数えるのは無理そうです……。
だから、たくさんの粒をひとまとめにして数える方法を考えたんだ。それが「モル(mol)」という単位なんだよ。1molは、6.02×10²³個の粒をまとめたものなんだ。
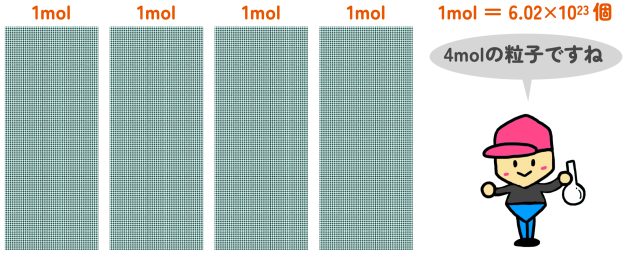
たしかにこうしたほうが数えやすくなりますね。
それにしても、6.02×10²³個ってすごく大きい数ですね!
そうだね。これを「アボガドロ数」って呼ぶんだ。1molの水分子(H2O)といえば6.02×10²³個の水分子の集まりということになるよ。そして、このmolを単位とした量を、「物質量」という。

でもなぜそんな大きくて中途半端な値を「1mol」にしちゃったんですか…
そう思うのも無理はないが、ちゃんと意味のある数字だよ。実は、
原子(分子)を6.02×1023個もってくると、質量〔g〕が原子量(分子量)と一致するようになっているんだ。と言ってもちょっとわかりにくいね、次の「モルと質量の関係」で詳しく解説するよ。

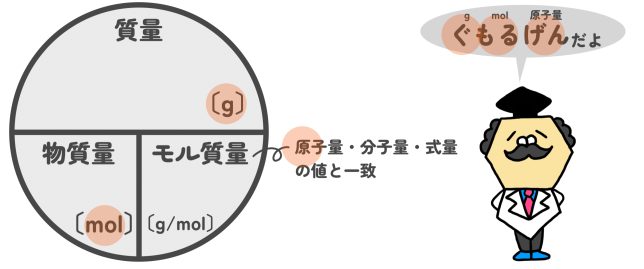
モル(物質量)と質量の関係(モル質量とは)
さて、モルと質量の関係について話そう。その前に、前回の授業で「原子量」や「分子量」について学んだのを覚えているかな?
はい!原子量は、12Cを基準として原子の重さを表した相対質量で、分子量は原子量を足し合わせたものですね。
その通り!じゃあ、原子量や分子量の単位って何だったかな?
えっと……単位はありませんでしたよね?
その通り。原子量や分子量は「相対的な値」だから単位がないんだ。
しかし、実際に実験をするときなどに、単位がないと物質を測れないよね。
そこで、1molの物質を持ってきたときに、何グラムになるかを考えてみるんだけど、12C(質量数と12の炭素)を6.02×1023個もってくると、ちょうど12gになるんだ。

質量数と、実際の質量が12で一致してわかりやすいだろう。
だから1molを6.02×1023個にしたんですね!
12C炭素が1molで、12g。つまり12C炭素は12〔g/mol〕だ。1molあたり、12gという意味だね。
これを「モル質量」と呼ぶ。モル質量の単位は〔g/mol〕だよ。

そして、質量数から原子量や分子量が決まったね。
そうなると、酸素原子Oの原子量は16(質量数16)だから、1molの酸素原子の質量は16gとなるし、水H2Oの分子量は18(質量数の和が18)だから、1molの水の質量は18gとなる。

じゃあ、モル質量は原子量や分子量に単位〔g/mol〕をつけたものってことですか?
それでいいよ。原子量や分子量の数字をそのまま使えば、モル質量が計算できるんだ。これがモル(mol)と質量をつなげる大事なポイントなんだよ。そのために、1molを6.02×1023個にしているんだね。
まだ完璧じゃないですけど、とりあえず意味がある数字だということはわかりました!
まぁ今はまだそれでいいか。計算をしながら、理解を深めていこう。
モル(物質量)の計算をしてみよう
問題 44gの二酸化炭素CO2は何molか。 原子量はC = 12, O = 16とする。
実際にmol(物質量)を計算してみよう。たとえば、44gの二酸化炭素CO2があったとするよ。これが何molかを求めてみようか。
えっと、まずCO2の分子量を求めればいいんですよね。
その通り。CO2は炭素(C)1個と酸素(O)2個でできているから、分子量は「12 + 16×2 = 44」だね。
44gあって、1molが44gなら……答えはちょうど1molですね!
正解!じゃあ、次に2molのCO2があったら何gになるかな?
問題 2molの二酸化炭素CO2は何gか。 原子量はC = 12, O = 16とする。
1molで44gだから、88gは2倍で2molになります!
その通り!こうやって、質量とモル(物質量)を簡単に行き来できるようになるんだよ。
モル、モルと言っていますけど、molは単位で、正しくは物質量、ですね。
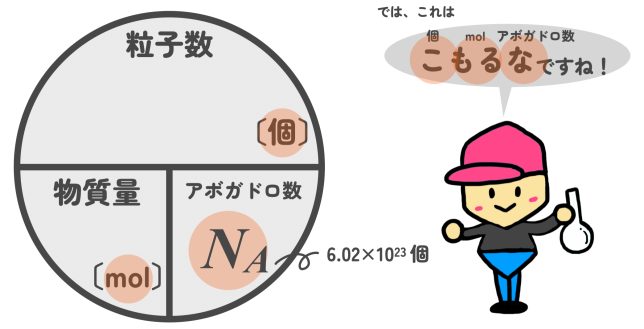
モル(物質量)と粒の関係
問題 2molのH2Oには何個の水分子が含まれているか。
次に、モルと粒の数について考えてみよう。たとえば、1molの水H2Oには何個の水分子が含まれているか覚えてる?
6.02×10²³個ですよね!
その通り!じゃあ、2molの水には何個の水分子が含まれているかな?
1molの2倍だから、6.02×10²³×2 = 1.204×10²⁴個ですね!
いいね!モル(物質量)にアボガドロ数を掛ければ、粒の数が求められるんだ。逆に、粒の数がわかっているときはアボガドロ数で割ればモル(物質量)を求められるよ。
モル(物質量)の実生活でのイメージ
先生、モルの計算はわかってきました。でも、モルって現実の世界でどう役立つんですか?
いい質問だね!モルは、化学反応を考えるときにとても便利なんだ。たとえば、車の燃料として使われるガソリンは、燃焼すると二酸化炭素CO2と水H2Oが出るよね。このとき、何モルのガソリンが燃えると、何モルのCO2が出るかを計算できるんだ。
さらに、食品のカロリー計算や医薬品の製造でも、モルの考え方を使って正確な量を測る必要があるんだよ。
身近なところでも役に立っているんですね!
まとめ
今日学んだモル(物質量)を簡単にまとめてみよう!
1. 物質量は、粒の数を表す量で、「モル(mol)」という単位で数える。
2. 1molは6.02×10²³個の粒子の集まり(アボガドロ数)。
3. 分子量や原子量を使って、モル質量〔g/mol〕を計算できる。
4. 質量、モル、粒の数は相互に変換できる。
物質量の考え方を使いこなせると、化学がもっと楽しくなるよ!次回は、これを使った化学反応式の計算について学んでいこう!
はい!ありがとうございました!
問題 次の(1)~(3)の物質1molの質量は何gか。 原子量はH = 1.0, O = 16, AI = 27とする。
(1) アルミニウム AI
(2) 水H2O
(3) 酸化アルミニウム Al2O3
答え ⑴ 27g ⑵ 18g ⑶ 102g










