化学結合には様々なものがありますが、その1つにイオン結合と呼ばれるものがあります。
ここでは、イオン結合の様子や組成式、名称の書き方を見ていきましょう。
イオン結合
化学を学習していく中で頻繁に出てくる「結合」というのが色々あってよくわかりません。
結合には様々な種類があるんだけど、今回はイオン結合について見ていこうか。
イオン結合というからには、イオンの結合なんですよね?
そうだね。例えばナトリウムイオンNa+と塩化物イオンCl−がイオン結合すると塩化ナトリウムNaClとなるよ。
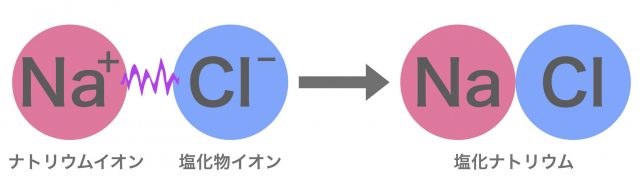
基本的に陽イオンになるのは金属元素で、陰イオンになるのは非金属元素だから、イオン結合は「金属元素と非金属元素の結合」と覚えておいて良いよ。
静電気力(クーロン力)
なぜ結合するんですか?
それは、ナトリウムイオンNa+が陽イオンで塩化物イオンCl−が陰イオンだからさ。+と−は引かれ合うんだよ。
プラスとマイナスが引かれあって結合するなんて、静電気みたいですね。
まさにその通りで、この引力は静電気力(クーロン力)と呼ばれているよ。
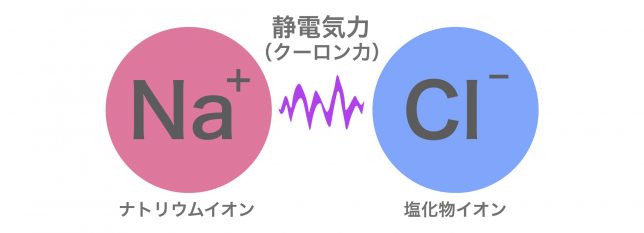
イオン結合は「陽イオンと陰イオンが静電気的な引力によって結合する」ということだね。
電荷を打ち消すように結合
ナトリウムイオンと塩化物イオンの場合は1対1の割合で結合だけど、カルシウムイオンと塩化物イオンの場合はどうなるとおもう?
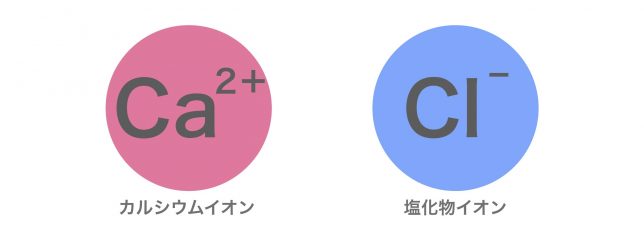
カルシウムイオンは2価のイオンですね。
ということはプラスの力を2つもっていますから、塩化物イオンを2つつなげられるのではないですか?
そのイメージでいいよ。
イオン結合はお互いの電荷を打ち消す割合で結合するんだ。

カルシウムイオンと塩化物イオンだと1対2の割合で結合するということですね。
イオン結晶
ここですごく勘違いしやすいことなんだけど、イオン結合によってできる物質は分子で存在してはいるわけではないんだ。
???
どういうことですか?
例えば、先ほどナトリウムイオンと塩化物イオンから塩化ナトリウムNaClができるとあったね。

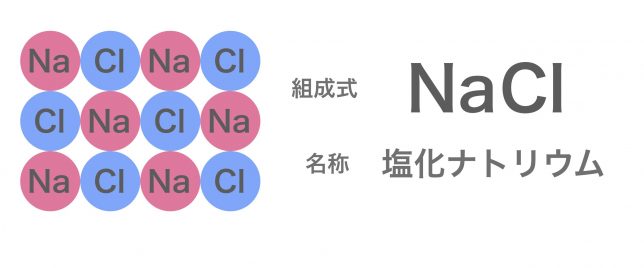
でも、実際の塩化ナトリウムはNaとCl一粒ずつ繋がった粒子ではなく、たくさんつながった結晶で存在しているよ。
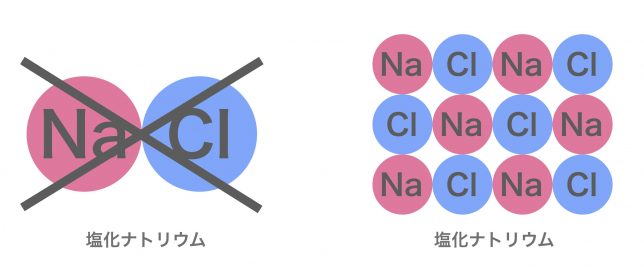
塩化ナトリウムNaClという粒ではなく、NaとClが1対1の割合でたくさんつかながっているということですか。
その通り。
このように、陽イオンと陰イオンがイオン結合が繰り返されて構成された結晶をイオン結晶と呼ぶよ。
組成式と名称
以上のことを踏まえて、イオン結合性の物質は分子式ではなく組成式という書き方で記すんだ。
組成式をかくときは陽イオンを前、陰イオンを後にして、+−の記号を取っ払うよ。
そして、陽イオンと陰イオンの割合を元素記号の右下に記そう。1は省略していいよ。
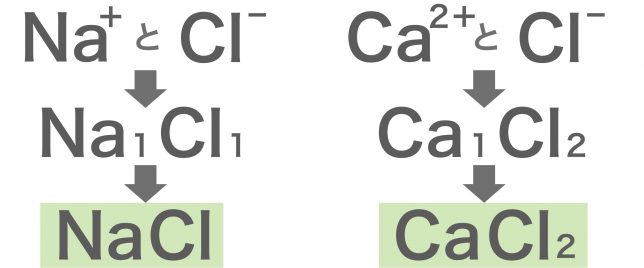
名称は陰イオンから読むんだ。
陰イオンの名称から「物イオン」をとりのぞき、陽イオンの名称から「イオン」をとりのぞき、2つをつなげるよ。

イオン結合性物質の性質
イオン結合によってできる物質の性質で覚えておくべきことを教えてください。
そうだね、まずひとつは「硬くて融点や沸点が高い」ということかな。イオン結合のもととなる静電気力は強いので、なかなかバラバラにならないんだ。
もうひとつは「脆い」ということだ。硬いんだけど、ハンマーとかで叩くとボロッと割れるよ。
硬いけど脆いってことですね。
なぜそのような性質になるんでしょうか。
それは、イオン結晶の配列が崩れてしまうと静電気的な引力が反発力に変わってしまうからなんだ。
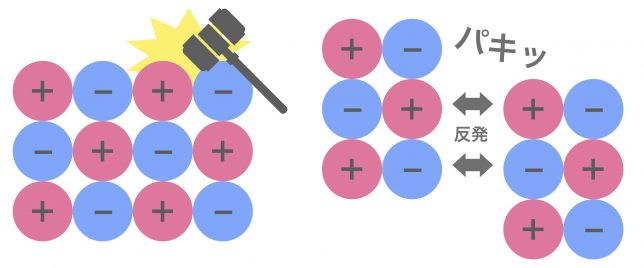
なるほど、石や岩塩がパキッと割れるのはこのためなんですね!
その様な性質を,「へき開」と言うよ。
✔︎イオン結合は陽イオンと陰イオンが静電気力で結合する。
✔︎イオン結合性物質はイオン結晶として存在する。
✔︎組成式と名称をかけるようにする。
✔︎イオン結晶は硬いが脆い。











